第六节 影响光合作用的因素
植物的光合作用受内外因素的影响,而衡量内外因素对光合作用影响程度的常用指标是光合速率(photosynthetic rate)。
| 一、光合速率及表示单位 光合速率通常是指单位时间、单位叶面积的CO2吸收量或O2的释放量,也可用单位时间、单位叶面积上的干物质积累量来表示。常用单位有:μmol CO2·m-2·s-1 (以前用mg·dm-2·h-1表示,1μmol·m-2·s-1=1.58mg·dm-2·h-1)、μmol O2·dm-2·h-1 和mgDW(干重)·dm-2·h-1。CO2吸收量用红外线CO2气体分析仪测定,O2释放量用氧电极测氧装置测定,干物质积累量可用改良半叶法等方法测定(请参照植物生理实验指导书)。有的测定光合速率的方法都没有把呼吸作用(光、暗呼吸)以及呼吸释放的CO2被光合作用再固定等因素考虑在内,因而所测结果实际上是表观光合速率(apparent photosynthetic rate)或净光合速率(net photosynthetic rate,Pn),如把表观光合速率加上光、暗呼吸速率,便得到总光合速率(gross photosyntheticrate)或真光合速率(true photosynthetic rate)。 |
| 二、内部因素 (一)叶片的发育和结构
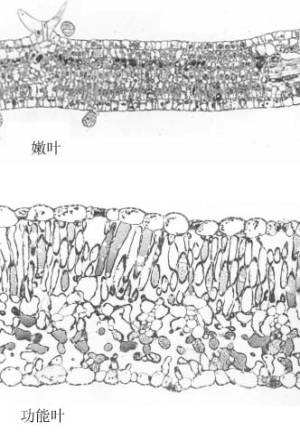
1.叶龄 新长出的嫩叶,光合速率很低。其主要原因有:(1)叶组织发育未健全,气孔尚未完全形成或开度小,细胞间隙小,叶肉细胞与外界气体交换速率低;(2)叶绿体小,片层结构不发达,光合色素含量低,捕光能力弱;(3)光合酶,尤其是Rubisco的含量与活性低。(4)幼叶的呼吸作用旺盛,因而使表观光合速率降低。但随着幼叶的成长,叶绿体的发育,叶绿素含量与Rubisco酶活性的增加,光合速率不断上升;当叶片长至面积和厚度最大时,光合速率通常也达到最大值,以后,随着叶片衰老,叶绿素含量与Rubisco酶活性下降,以及叶绿体内部结构的解体,光合速率下降。 依据光合速率随叶龄增长出现“低—高—低”的规律,可推测不同部位叶片在不同生育期的相对光合速率的大小。如处在营养生长期的禾谷类作物,其心叶的光合速率较低,倒3叶的光合速率往往最高;而在结实期,叶片的光合速率应自上而下地衰减。 2.叶的结构 叶的结构如叶厚度、栅栏组织与海绵组织的比例、叶绿体和类囊体的数目等都对光合速率有影响。叶的结构一方面受遗传因素控制,另一方面还受环境影响。 C4植物的叶片光合速率通常要大于C3植物,这与C4植物叶片具有花环结构等特性有关。许多植物的叶组织中有两种叶肉细胞,靠腹面的为栅栏组织细胞;靠背面的为海绵组织细胞。栅栏组织细胞细长,排列紧密,叶绿体密度大,叶绿素含量高,致使叶的腹面呈深绿色,且其中Chla/b比值高,光合活性也高,而海绵组织中情况则相反。生长在光照条件下的阳生植物(sun plant)叶栅栏组织要比阴生植物(shade plant)叶发达,叶绿体的光合特性好,因而阳生叶有较高的光合速率。 同一叶片,不同部位上测得的光合速率往往不一致。例如,禾本科作物叶尖的光合速率比叶的中下部低,这是因为叶尖部较薄,且易早衰的缘故。 (二)光合产物的输出 光合产物(蔗糖)从叶片中输出的速率会影响叶片的光合速率。例如,摘去花、果、顶芽等都会暂时阻碍光合产物输出,降低叶片特别是邻近叶的光合速率;反之,摘除其他叶片,只留一张叶片与所有花果,留下叶的光合速率会急剧增加,但易早衰。对苹果等果树枝条环割,由于光合产物不能外运,会使环割上方枝条上的叶片光合速率明显下降。光合产物积累到一定的水平后会影响光合速率的原因有:(1)反馈抑制。例如蔗糖的积累会反馈抑制合成蔗糖的磷酸蔗糖合成酶sucrose phosphate synthetase,SPS)的活性,使F6P增加。而F6P的积累,又反馈抑制果糖1,6-二磷酸酯酶活性,使细胞质以及叶绿体中磷酸丙糖含量增加,从而影响CO2的固定;(2)淀粉粒的影响。叶肉细胞中蔗糖的积累会促进叶绿体基质中淀粉的合成与淀粉粒的形成,过多的淀粉粒一方面会压迫与损伤类囊体,另一方面,由于淀粉粒对光有遮挡,从而直接阻碍光合膜对光的吸收。 |
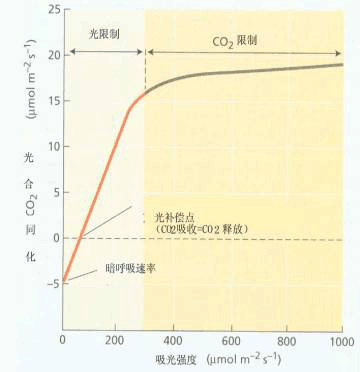
| 三 外部因素 (一)光照 光是光合作用的动力,也是形成叶绿素、叶绿体以及正常叶片的必要条件,光还显著地调节光合酶的活性与气孔的开度,因此光直接制约着光合速率的高低。光照因素中有光强、光质与光照时间,这些对光合作用都有深刻的影响。 1.光强 (1)光强-光合曲线 图4-26是光强-光合速率关系的模式图。
暗中叶片不进行光合作用,只有呼吸作用释放CO2 (图4-26中的OD为呼吸速率)。随着光强的增高,光合速率相应提高,当到达某一光强时,叶片的光合速率等于呼吸速率,即CO2吸收量等于CO2释放量,表观光合速率为零,这时的光强称为光补偿点(light compensation point)。在低光强区,光合速率随光强的增强而呈比例地增加(比例阶段,直线A);当超过一定光强,光合速率增加就会转慢(曲线B);当达到某一光强时,光合速率就不再增加,而呈现光饱和现象。开始达到光合速率最大值时的光强称为光饱和点(light saturation point),此点以后的阶段称饱和阶段(直线C)。比例阶段中主要是光强制约着光合速率,而饱和阶段中CO2扩散和固定速率是主要限制因素。用比例阶段的光强-光合曲线的斜率(表观光合速率/光强)可计算表观光合量子产额。
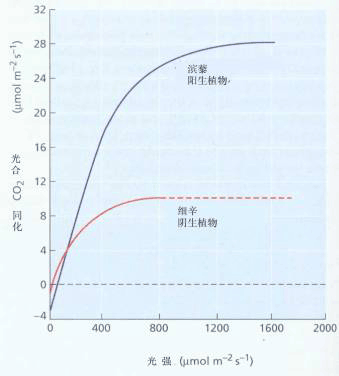
植物的光补偿点和光饱和点不是固定数值,它们会随外界条件的变化而变动,例如,当CO2浓度增高或温度降低时,光补偿点降低;而当CO2浓度提高时,光饱和点则会升高。在封闭的温室中,温度较高,CO2较少,这会使光补偿点提高而对光合积累不利。在这种情况下应适当降低室温,通风换气,或增施CO2才能保证光合作用的顺利进行。 在一般光强下,C4植物不出现光饱和现象,其原因是:①C4植物同化CO2消耗的同化力要比C3植物高 ②PEPC对CO2的亲和力高,以及具有“CO2泵”,所以空气中CO2浓度通常不成为C4植物光合作用的限制因素。 (2)强光伤害—光抑制 光能不足可成为光合作用的限制因素,光能过剩也会对光合作用产生不利的影响。当光合机构接受的光能超过它所能利用的量时,光会引起光合速率的降低,这个现象就叫光合作用的光抑制(photoinhibition of photosynthesis)。 晴天中午的光强常超过植物的光饱和点,很多C3植物,如水稻、小麦、棉花、大豆、毛竹、茶花等都会出现光抑制,轻者使植物光合速率暂时降低,重者叶片变黄,光合活性丧失。当强光与高温、低温、干旱等其他环境胁迫同时存在时,光抑制现象尤为严重。通常光饱和点低的阴生植物更易受到光抑制危害,若把人参苗移到露地栽培,在直射光下,叶片很快失绿,并出现红褐色灼伤斑,使参苗不能正常生长;大田作物由光抑制而降低的产量可达15%以上。因此光抑制产生的原因及其防御系统引起了人们的重视。 光抑制机理 一般认为光抑制主要发生在PSⅡ。按其发生的原初部位可分为受体侧光抑制和供体侧光抑制。受体侧光抑制常起始于还原型QA的积累。还原型QA的积累促使三线态P680(P680T)的形成,而P680T可以与氧作用(P680T O2→P680 1O2)形成单线态氧(1O2);供体侧光抑制起始于水氧化受阻。由于放氧复合体不能很快把电子传递给反应中心,从而延长了氧化型P680(P680 )的存在时间。P680 和1O2都是强氧化剂,如不及时消除,它们都可以氧化破坏附近的叶绿素和D1蛋白,从而使光合器官损伤,光合活性下降。 保护机理 植物有多种保护防御机理,用以避免或减少光抑制的破坏。如:(1)通过叶片运动,叶绿体运动或叶表面覆盖蜡质层、积累盐或着生毛等来减少对光的吸收;(2)通过增加光合电子传递和光合关键酶的含量及活化程度,提高光合能力等来增加对光能的利用;(3)加强非光合的耗能代谢过程,如光呼吸、Mehler反应等;(4)加强热耗散过程,如蒸腾作用;(5)增加活性氧的清除系统,如超氧物歧化酶(SOD)、谷胱甘肽还原酶等的量和活性;(6)加强PSⅡ的修复循环等。 光抑制引起的破坏与自身的修复过程是同时发生的,两个相反过程的相对速率决定光抑制程度和对光抑制的忍耐性。光合机构的修复需要弱光和合适的温度,以及维持适度的光合速率,并涉及到一些物质如D1等蛋白的合成。如果植物连续在强光和高温下生长,那么光抑制对光合器的损伤就难以修复了。
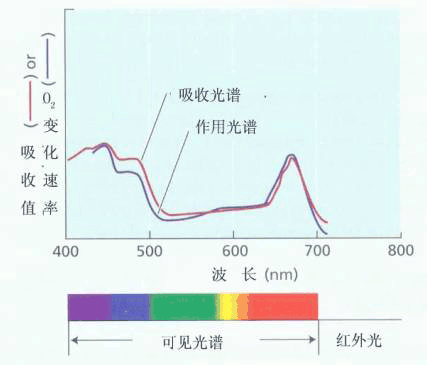
在作物生产上,保证作物生长良好,使叶片的光合速率维持较高的水平,加强对光能的利用,这是减轻光抑制的前提。同时采取各种措施,尽量避免强光下多种胁迫的同时发生,这对减轻或避免光抑制损失也是很重要的。另外,强光下在作物上方用塑料薄膜遮阳网或防虫网等遮光,能有效防止光抑制的发生,这在蔬菜花卉栽培中已普遍应用。 2.光质 在太阳幅射中,只有可见光部分才能被光合作用利用。用不同波长的可见光照射植物叶片,测定到的光合速率(按量子产额比较)不一样(图4-28)。在600~680nm红光区,光合速率有一大的峰值,在435nm左右的蓝光区又有一小的峰值。可见,光合作用的作用光谱与叶绿体色素的吸收光谱大体吻合。 在自然条件下,植物或多或少会受到不同波长的光线照射。例如,阴天不仅光强减弱,而且蓝光和绿光所占的比例增高。树木的叶片吸收红光和蓝光较多,故透过树冠的光线中绿光较多,由于绿光是光合作用的低效光,因而会使树冠下生长的本来就光照不足的植物利用光能的效率更低。“大树底下无丰草”就是这个道理。 水层同样改变光强和光质。水层越深,光照越弱,例如,20米深处的光强是水面光强的二十分之一,如水质不好,深处的光强会更弱。水层对光波中的红、橙部分吸收显著多于蓝、绿部分,深水层的光线中短波长的光相对较多。所以含有叶绿素、吸收红光较多的绿藻分布于海水的表层;而含有藻红蛋白、吸收绿、蓝光较多的红藻则分布在海水的深层,这是海藻对光适应的一种表现。 3.光照时间 对放置于暗中一段时间的材料(叶片或细胞)照光,起初光合速率很低或为负值,要光照一段时间后,光合速率才逐渐上升并趋与稳定。从照光开始至光合速率达到稳定水平的这段时间,称为“光合滞后期”(lag phase of photosynthesis)或称光合诱导期。一般整体叶片的光合滞后期约30~60min,而排除气孔影响的去表皮叶片,细胞、原生质体等光合组织的滞后期约10min。将植物从弱光下移至强光下,也有类似情况出现。另外,植物的光呼吸也有滞后现象。在光合的滞后期中光呼吸速率与光合速率会按比例上升(图4-29)。 产生滞后期的原因是光对酶活性的诱导以及光合碳循环中间产物的增生需要一个准备过程,而光诱导气孔开启所需时间则是叶片滞后期延长的主要因素。 由于照光时间的长短对植物叶片的光合速率影响很大,因此在测定光合速率时要让叶片充分预照光。
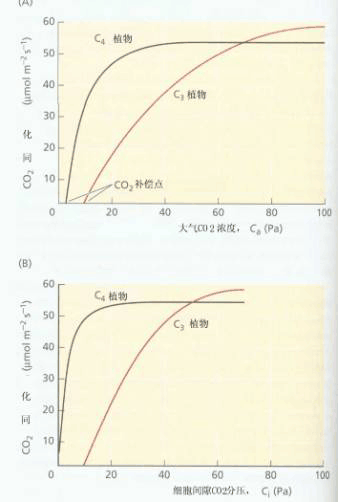
曲线上四个点对应浓度分别为CO2补偿点(C),空气浓度下细胞间隙的CO2浓度(n),与空气浓度相同的细胞间隙CO2浓度(350μl·L-1左右)和CO2饱和点(S)。Pm为最大光合速率;CE为比例阶段曲线斜率,代表羧化效率;OA光下叶片向无CO2气体中的释放速率,可代表光呼吸速率。 (二)CO2 1.CO2-光合曲线 CO2-光合曲线(图4-30)与光强光合曲线相似,有比例阶段与饱和阶段。光下CO2浓度为零时叶片只有光、暗呼吸,释放CO2。图中的OA部分为光下叶片向无CO2气体中的CO2释放速率(实质上是光呼吸、暗呼吸、光合三者的平衡值),通常用它来代表光呼吸速率。在比例阶段,光合速率随CO2浓度增高而增加,当光合速率与呼吸速率相等时,环境中的CO2浓度即为CO2补偿点(CO2 compensation point,图中C点);当达到某一浓度(S)时,光合速率便达最大值(PM),开始达到光合最大速率时的CO2浓度被称为CO2饱和点(CO2 saturation point)。在CO2-光合曲线的比例阶段,CO2浓度是光合作用的限制因素,直线的斜率(CE)受Rubisco活性及活化Rubisco量的限制,因而CE被称为羧化效率(carboxylation efficiency)。从CE的变化可以推测Rubisco的量和活性,CE大,即在较低的CO2浓度时就有较高的光合速率,也就是说Rubisco的羧化效率高。在饱和阶段,CO2已不是光合作用的限制因素,而CO2受体的量,即RuBP的再生速率则成为影响光合的因素。由于RuBP再生受ATP供应的影响,所以饱和阶段光合速率反映了光合电子传递和光合磷酸化活性,因而Pm被称为光合能力。
图4-31 C3植物与C4植物的CO2光合曲线比较 A.光合速率与外界CO2浓度; B.光合速率与细胞间隙CO2浓度(计算值);C4植物为Tidestromia oblogifolia; C3 植物为Larrea divaricata 比较C3植物与C4植物CO2-光合曲线(图4-31),可以看出:(1)C4植物的CO2补偿点低,在低CO2浓度下光合速率的增加比C3快,CO2的利用率高;(2) C2植物的CO2饱和点比C3植物低,在大气CO2浓度下就能达到饱和;而C3植物CO2饱和点不明显,光合速率在较高CO2浓度下还会随浓度上升而提高。C4植物CO2饱和点低的原因,可能与C4植物的气孔对CO2浓度敏感有关,即CO2浓度超过空气水平后,C4植物气孔开度就变小。另外,C4植物PEPC的Km低,对CO2亲和力高,有浓缩CO2机制,这些也是C4植物CO2饱和点低的原因。 在正常生理情况下,植物CO2补偿点相对稳定,例如小麦100个品种的CO2补偿点为52±2μl·L-1,大麦125个品种为55±2μl·L-1,玉米125个品种为1.3±1.2μl·L-1 ,猪毛菜(CAM植物) CO2补偿点不超过10μl·L-1 。有人测定了数千株燕麦和5万株小麦的幼苗,尚未发现一株具有类似C4植物低CO2补偿点的幼苗。在温度上升、光强减弱、水分亏缺、氧浓度增加等条件下,CO2补偿点也随之上升。
2.CO2供给 CO2是光合作用的碳源,陆生植物所需的CO2主要从大气中获得。 CO2从大气至叶肉细胞间隙为气相扩散,而从叶肉细胞间隙到叶绿体基质则为液相扩散,扩散的动力为. CO2浓度差。
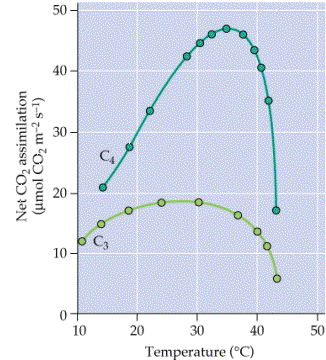
图 4-32 不同 CO2浓度下温度对光合速率的影响 a.在饱和CO2浓度下;b.在大气. CO2浓度下 (Berty and Bojorkman 1980) 空气中的. CO2浓度较低,约为350μl·L-1 (0.035%),分压为3.5×10-5 MPa,而一般C3植物的. CO2饱和点为1 000~1 500μl·L-1 左右,是空气中的3~5倍。在不通风的温室、大棚和光合作用旺盛的作物冠层内的. CO2浓度可降至200μl·L-1左右。由于光合作用 对. CO2的消耗以及存在. CO2扩散阻力,因而叶绿体基质中的. CO2浓度很低,接近. CO2补偿点。因此,加强通风或设法增施. CO2能显著提高作物的光合速率,这对C3植物尤为明显。 (三)温度 光合过程中的暗反应是由酶所催化的化学反应,因而受温度影响。在强光、高. CO2浓度时温度对光合速率的影响要比弱光、低. CO2浓度时影响大(图4-32),这是由于在强光和高. CO2条件下,温度能成为光合作用的主要限制因素。 光合作用有一定的温度范围和三基点。光合作用的最低温度(冷限)和最高温度(热限)是指该温度下表观光合速率为零,而能使光合速率达到最高的温度被称为光合最适温度。光合作用的温度三基点因植物种类不同而有很大的差异(表4-6)。如耐低温的莴苣在5℃就能明显地测出光合速率,而喜温的黄瓜则要到20℃时才能测到;耐寒植物的光合作用冷限与细胞结冰温度相近;而起源于热带的植物,如玉米、高粱、橡胶树等在温度降至10~5℃时,光合作用已受到抑制。低温抑制光合的原因主要是低温时膜脂呈凝胶相,叶绿体超微结构受到破坏。此外,低温时酶促反应缓慢,气孔开闭失调,这些也是光合受抑的原因。 从表4-6可知,C4植物的热限较高,可达50~60℃,而C3植物较低,一般在40~50℃。乳熟期小麦遇到持续高温,尽管外表上仍呈绿色,但光合功能已严重受损。产生光合作用热限的原因:一是由于膜脂与酶蛋白的热变性,使光合器官损伤,叶绿体中的酶钝化;二是由于高温刺激了光暗呼吸,使表观光合速率迅速下降。 昼夜温差对光合净同化率有很大的影响。白天温度高,日光充足,有利于光合作用的进行;夜间温度较低,降低了呼吸消耗,因此,在一定温度范围内,昼夜温差大有利于光合积累。
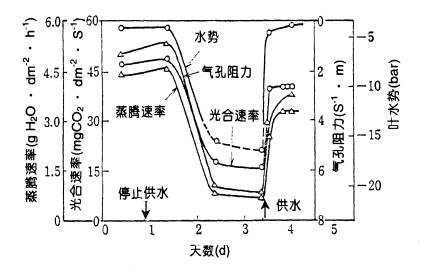
(四)水分 水分对光合作用的影响有直接的也有间接的原因。直接的原因是水为光合作用的原料,没有水不能进行光合作用。但是用于光合作用的水不到蒸腾失水的1%,因此缺水影响光合作用主要是间接的原因。 水分亏缺会使光合速率下降。在水分轻度亏缺时,供水后尚能使光合能力恢复,倘若水分亏缺严重,供水后叶片水势虽可恢复至原来水平,但光合速率却难以恢复至原有程度(图4-33)。因而在水稻烤田,棉花、花生蹲苗时,要控制烤田或蹲苗程度,不能过头。
图4-33 向日葵在严重水分亏缺时以及在复水过程中 叶水势、光合速率、气孔阻力、蒸腾速率变化 水分亏缺降低光合的主要原因有: (1)气孔导度下降 叶片光合速率与气孔导度呈正相关,当水分亏缺时,叶片中脱落酸量增加,从而引起气孔关闭,导度下降,进入叶片的. CO2减少。开始引起气孔导度和光合速率下降的叶片水势值,因植物种类不同有较大差异:水稻为-0.2~-0.3MPa;玉米为-0.3~-0.4MPa;而大豆和向日葵则在-0.6~-1.2MPa间。 (2)光合产物输出变慢 水分亏缺会使光合产物输出变慢,加之缺水时,叶片中淀粉水解加强,糖类积累,结果会引起光合速率下降。 (3)光合机构受损 缺水时叶绿体的电子传递速率降低且与光合磷酸化解偶联,影响同化力的形成。严重缺水还会使叶绿体变形,片层结构破坏,这些不仅使光合速率下降,而且使光合能力不能恢复。 (4)光合面积扩展受抑 在缺水条件下,生长受抑,叶面积扩展受到限制。有的叶面被盐结晶、被绒毛或蜡质覆盖,这样虽然减少了水分的消耗,减少光抑制,但同时也因对光的吸收减少而使得光合速率降低。 水分过多也会影响光合作用。土壤水分太多,通气不良妨碍根系活动,从而间接影响光合;雨水淋在叶片上,一方面遮挡气孔,影响气体交换,另一方面使叶肉细胞处于低渗状态, 这些都会使光合速率降低。 (五)矿质营养 矿质营养在光合作用中的功能极为广泛,归纳起来有以下几方面: 1.叶绿体结构的组成成分 如N、P、S、Mg是叶绿体中构成叶绿素、蛋白质、核酸以及片层膜不可缺少的成分。 2.电子传递体的重要成分 如PC中含Cu,Fe-S中心、Cytb、Cytf和Fd中都含Fe,放氧复合体不可缺少Mn2 和Cl- 。 3.磷酸基团的重要作用 构成同化力的ATP和NADPH,光合碳还原循环中所有的中间产物,合成淀粉的前体ADPG,以及合成蔗糖的前体UDPG,这些化合物中都含有磷酸基团。 4.活化或调节因子 如Rubisco,FBPase等酶的活化需要Mg2 ;Fe、Cu、Mn、Zn参与叶绿素的合成;K 和Ca2 调节气孔开闭;K和P促进光合产物的转化与运输等。 肥料三要素中以N对光合影响最为显著。在一定范围内,叶的含N量、叶绿素含量、Rubisco含量分别与光合速率呈正相关。叶片中含N量的80%在叶绿体中,施N既能增加叶绿素含量,加速光反应,又能增加光合酶的含量与活性,加快暗反应。从N素营养好的叶片中提取出的Rubisco不仅量多,而且活性高。然而也有试验指出当Rubisco含量超过一定值后,酶量就不与光合速率成比例。 重金属铊、镉、镍和铅等都对光合作用有害,它们大都影响气孔功能。另外,镉对PSⅡ活性有抑制作用。 (六)光合速率的日变化 一天中,外界的光强、温度、土壤和大气的水分状况、空气中的. CO2浓度以及植物体的水分与光合中间产物含量、气孔开度等都在不断地变化,这些变化会使光合速率发生日变化,其中光强日变化对光合速率日变化的影响最大。在温暖、水分供应充足的条件下,光合速率变化随光强日变化呈单峰曲线,即日出后光合速率逐渐提高,中午前达到高峰,以后逐渐降低,日落后光合速率趋于负值(呼吸速率)。如果白天云量变化不定,则光合速率会随光强的变化而变化。
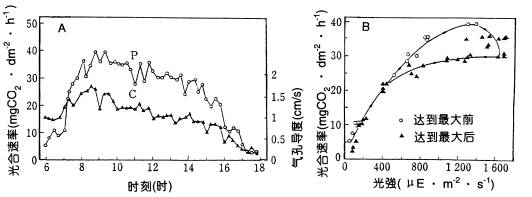
A.光合速率(P)和气孔导度(C)平行变化; B.由A图数据绘制的光合速率与光强的关系,在相同光强下,上午光合速率要大于下午的光合速率 另外,光合速率也同气孔导度的变化相对应(图4-34A)。在相同光强时,通常下午的光合速率要低于上午的光合速率(图4-34B),这是由于经上午光合后,叶片中的光合产物有积累而发生反馈抑制的缘故。当光照强烈、气温过高时,光合速率日变化呈双峰曲线,大峰在上午,小峰在下午,中午前后,光合速率下降,呈现“午睡”现象(midday depression of photo-synthesis),且这种现象随土壤含水量的降低而加剧(图4-35)。引起光合“午睡”的主要因素是大气干旱和土壤干旱。在干热的中午,叶片蒸腾失水加剧,如此时土壤水分也亏缺,那么植株的失水大于吸水,就会引起萎蔫与气孔导度降低,进而使 CO2吸收减少。另外,中午及午后的强光、高温、低. CO2浓度等条件都会使光呼吸激增,光抑制产生,这些也都会使光合速率在中午或午后降低。 光合“午睡”是植物遇干旱时的普遍发生现象,也是植物对环境缺水的一种适应方式。但是“午睡”造成的损失可达光合生产的30%,甚至更多,所以在生产上应适时灌溉,或选用抗旱品种,增强光合能力,以缓和“午睡”程度。 图 4-35 桑叶光合速率随着土壤水分减少的日变化 A.光合日变化; B.土壤含水量 图中数字为降雨后的天数 (Tazaki等,1980) |