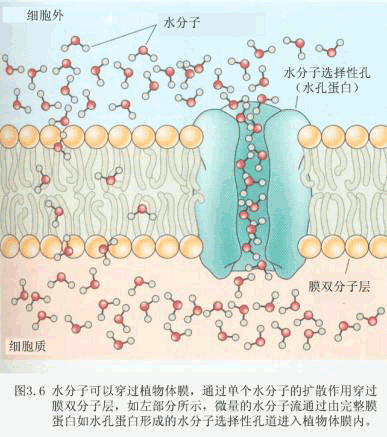
| 第二节 植物细胞对水分的吸收 一、植物细胞的水势 (一)细胞水势的组分 植物细胞与一个开放的溶液体系有所不同,它外有细胞壁,内有大液泡,液泡中有溶质,细胞中还有多种亲水衬质,这些都会对细胞水势产生影响。因此植物细胞水势比纯溶液的水势要复杂得多,至少要受到三个组分的影响,即溶质势ψs、压力势ψp和衬质势ψm。 1.细胞的溶质势 植物细胞中含有大量溶质,其中主要有无机离子、糖类、有机酸、色素等。悬浮在细胞液中的蛋白质、核酸等高分子物质也可视为溶质。细胞液所具有的溶质势是各种溶质势的总和。细胞液中溶质的质点数愈多,细胞液的溶质势就越低。植物细胞的溶质势会因植物种类而不同。一般陆生植物叶片细胞的溶质势是-2~-1MPa,旱生植物叶片细胞的溶质势可以低到-10MPa。溶质势主要受细胞液浓度的影响,因此,凡是影响细胞液浓度的内外条件,都可引起溶质势的改变。例如干旱时,细胞液浓度高,溶质势较低。 2.细胞的压力势 原生质体吸水膨胀,对细胞壁产生的压力称为膨压(turgor pressure)。细胞壁在受到膨压作用的同时会产生一种与膨压大小相等、方向相反的壁压,即压力势。压力势一般为正值,它提高了细胞的水势。草本植物叶肉细胞的压力势,在温暖天气的午后为0.3~0.5MPa,晚上则达1.5MPa。在特殊情况下,压力势也可为负值或等于零。例如初始质壁分离时,细胞的压力势为零;剧烈蒸腾时,细胞壁出现负压,即细胞的压力势呈负值。 3.细胞的衬质势是指细胞中的亲水物质如蛋白质体、淀粉粒、染色体和膜系统等对自由水的束缚而引起水势的降低值。衬质势呈负值。 4.细胞的水势组成 有液泡的细胞和无液泡的细胞因体系的组成不同,在水势组成上也有差异。未形成液泡的细胞,如分生组织细胞,其含水体系主要由细胞质构成,在细胞质里除含有小分子的溶质外,还悬浮有较多的衬质,另外细胞吸水后也存在壁压,因此细胞的水势可用细胞质的水势表示: ψ细胞=ψ细胞质=ψs ψm ψp (2-30) 对于含有液泡的成熟细胞来说,其含水体系有液泡、细胞质,此外还有各种有膜结构的细胞器体系,且各体系均有自己的水势。然而当细胞处于水分平衡时,细胞内各含水体系的水势值应是相等的,否则各部分的水会发生移动。也就是说,细胞的水势可用任何部分的含水体系的水势来表示: ψ细胞=ψ细胞质=ψ液泡=ψ细胞器 由于细胞质水势组分较为复杂,各细胞器中水势又难以直接测定,而液泡的水势相对较易测定,因此,细胞水势通常用液泡的水势来代替。由于具有液泡的细胞含水量很高,衬质势趋于0,可忽略不计。因此细胞水势公式可用下式表示: ψ细胞=ψ液泡=ψs ψp (2-31) (二)细胞的吸水形式 植物细胞的水势主要由ψs、ψm和ψp组成,其中某一组分的变化都会改变细胞水势值及其与周围环境水势的差值,从而影响细胞吸水能力。据此,将植物细胞吸水方式分为以下三种: 1.渗透吸水(osmotic absorption of water)指由于ψs的下降而引起的细胞吸水。含有液泡的细胞吸水,如根系吸水、气孔开闭时保卫细胞的吸水主要为渗透吸水。 我们可以把液泡化的植物细胞看作一渗透计,植物的成熟细胞中的质膜、液泡膜等生物膜是半透膜,它们只允许水分和某些小分子物质通过,其他物质则不能或不易通过。为了便于讨论,常把由液泡膜、质膜和其间的细胞质构成的原生质层看作是一半透膜。液泡中含有糖、无机盐等多种物质,具有一定的溶质势,当把植物细胞置于清水或溶液中,细胞就会发生渗透作用。如果液泡的水势高于外液的水势,液泡就失水,细胞收缩,体积变小。由于细胞壁的伸缩性有限,而原生质层的伸缩性较大,当细胞继续失水时,原生质层便和细胞壁慢慢分离开来,这种现象被称为质壁分离(plasmolysis)。 如果把发生了质壁分离的细胞浸在水势较高的稀溶液或清水中,外液中的水分又会进入细胞,液泡变大,整个原生质层很快会恢复原来的状态,重新与细胞壁相贴,这种现象称为质壁分离复原(deplasmolysis)。我们可以利用细胞质壁分离和质壁分离复原的现象判断细胞死活,利用初始质壁分离测定细胞的渗透势。 应当指出,在成熟细胞吸水或失水过程中,不仅仅是液泡的吸水和失水,细胞质以及细胞质中的细胞器、细胞核等部分的水分也会随之而发生得失。这是因为,在整个细胞中,液泡、细胞质、核、细胞器等各部分的水势在细胞水分平衡时是相等的。当其中某一部分发生水分变化即水势变化时,也会带动其它部分的水分发生变化。在液泡失水时,细胞质也必定失水。 1988年在人体细胞中发现了一种存在生物膜上的分子量为28000的具有通透水分功能的内在蛋白被称为水通道蛋白(water channel protein)或称为水孔蛋白(aquaporins,AQPs),不久便证实在植物的细胞膜及液泡膜上也有水通道蛋白的存在。水通道蛋白不具有“水泵”功能,其作用是通过减小水越膜运动的阻力而使细胞间水分迁移的速率加快。水通道蛋白的嵌入使生物膜对水的通透能力大大提高,因此可以通过改变水孔蛋白的活性和调节水孔蛋白在膜上的丰度两种途径来调节膜对水的通透能力。
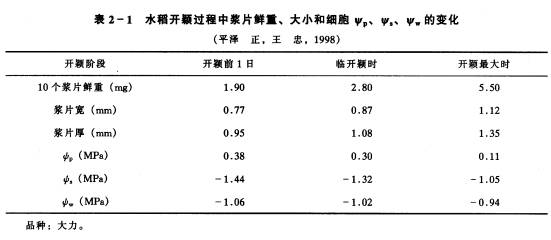
在干燥的种子中,组成原生质、细胞壁的胶体物质都处于凝胶状态,这些凝胶分子与水分子间有很大的引力,水分子(液态的水或气态的水蒸气)会迅速以扩散和毛细管作用通过小缝隙进入凝胶内部。胶体吸引水分子的力量称为吸胀力,而亲水胶体物质吸水膨胀的现象则称为吸胀作用(imbibition)。蛋白质类物质吸胀力最大,淀粉次之,纤维素较小。因此富含蛋白质的豆类种子的吸胀作用比禾谷类种子要显著。豆科植物种子的子叶中含有大量的蛋白质,而种皮中则有较多的纤维素,所以在豆科植物种子的吸胀过程中,由于子叶的吸胀力较种皮大而使种皮被胀破。 细胞吸胀力的大小,取决于衬质水势的高低。干燥种子衬质水势常低于-10MPa,有的甚至达-100MPa,所以吸胀吸水就很容易发生。当种子吸水后,衬质势很快上升。如将种子放在纯水中,当种子吸水膨胀达到最大程度时,ψm=ψw=0。由于吸胀过程与细胞的代谢活动没有直接关系,所以又把吸胀吸水称为非代谢性吸水。 3.降压吸水(negative pressure absorption of water)本文是指因ψp的降低而引发的细胞吸水。如蒸腾旺盛时,木质部导管和叶肉细胞(特别是萎蔫组织)的细胞壁都因失水而收缩,使压力势下降,从而引起这些细胞水势下降而吸水。失水过多时,还会使细胞壁向内凹陷而产生负压,这时ψp<0,细胞水势更低,吸水力更强。此外,细胞的生长吸水也依靠压力势的降低,因为只有在细胞壁松弛和压力势降低时细胞生长才能进行。 水稻开花时颖壳的张开是由着生在颖花内的浆片吸水膨大所致。采用图2-5装置,可测定开颖过程浆片细胞ψp、ψs的变化(表2-1)。从表2-1中可以看出,浆片的吸水膨大是由细胞壁松弛、压力势下降引起的。王忠(1986)发现浓度>5%的CO2气体或PH〈5.6的CO2水溶液能显著促进水稻颖花开颖,其原因是CO2诱导了浆片表皮细胞壁的松驰,使浆片细胞的压力势下降。CO2促进开颖的效应可应用于水稻杂交育种。
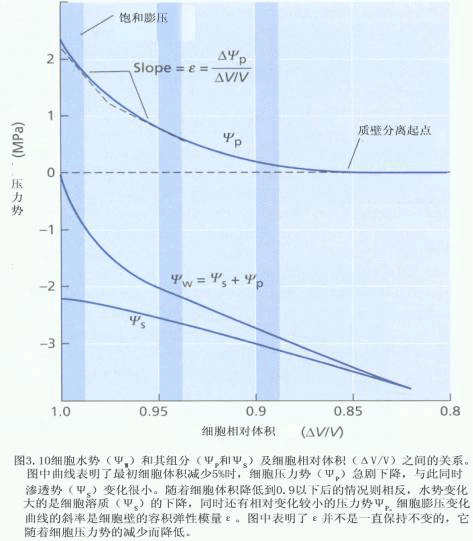
(三)细胞吸水过程中水势组分的变化 植物细胞吸水与失水取决于细胞与外界环境之间的水势差(△ψw)。当细胞水势低于外界的水势时,细胞就吸水;当细胞水势高于外界的水势时,细胞就失水;而当细胞水势等于外界水势时,水分交换达动态平衡。植物细胞在吸水和失水的过程中,细胞体积会发生变化,其水势、溶质势和压力势等都会随之改变(图2-2)。
以上表明,细胞ψw及其组分ψp、ψs与细胞相对体积间的关系密切,细胞的水势不是固定不变的,ψss、ψp、ψw会随含水量的增加而增高,植物细胞颇似一个自动调节的渗透系统。 |
| 二、植物细胞和组织水势的测定方法 植株尤其是叶片的水势可以敏感地反映植株的水分状况,它可作为灌溉生理指标而应用于生产。以下介绍几种测定水势的方法。
将植物组织放在已知水势的一系列溶液中,如果组织的水势(ψ细)小于某一溶液的水势(ψ外),则组织吸水,反之组织失水。若两者相等,水分交换保持动态平衡。组织的吸水或失水会使溶液的浓度、比重、电导以及组织本身的体积与重量发生变化。根据这些参数的变化情况可确定与植物组织等水势的溶液。 液体交换法测定水势的方法有很多种,各种方法的原理列于下表。 表 2-2 液体交换法测定水势的种类与原理判据△ψ=ψ外-ψ细组织的水分得失组织的体积、长度或重量变化外液的比重变化外液的浓度变化外液的电导变化△ψ>0吸水增加升高增加增高△ψ<0失水降低降低降低降低△ψ=0平衡不变不变不变不变测定方法组织体积(重量)法小液流法折射仪法电导仪法直尺(天平)测量组织的体积(重量)变化用毛细移液管测定外液的比重变化用折射仪测定外液的浓度变化用电导仪测定外液的电导变化适用的材料块茎、块根和果实叶片或碎的组织叶片或碎的组织叶片或碎的组织
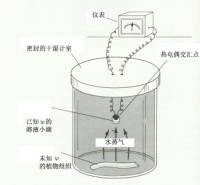
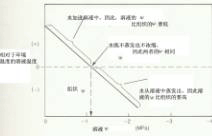
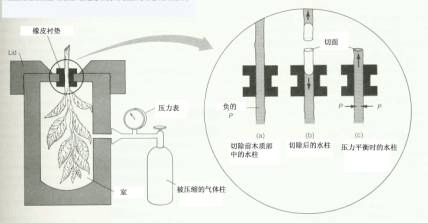
a.测定仪器示意图; b.小液滴水势与植物组织水势差与传感器温度的关系有时,所配溶液水势不正好等于组织的水势,此时可采用作图法来推算(类似图2-3b所示)。 (二) 蒸气压法 该法用于测定含有样品的密闭容器中的水蒸气压。包括使用热电偶或热敏电阻干湿球湿度计法、露点热电偶湿度计法以及体积张力计法(悬滴法)等。 这里简单介绍一下运用热电偶测定气、液等水势值的方法。把植物组织样品封入小室中,小室内装有作为温度传感器的热电偶(thermocouple),热电偶上带一滴溶液(图2-3)。开始时,水分同时从组织和液滴蒸发,使小室内的湿度升高,直至小室中的空气被水蒸气饱和或接近饱和。此时,如果植物组织与液滴的水势相同,则在组织与液滴间就没有水分的净迁移,液滴的温度将与环境温度相同。如果二者水势不同,则会发生水分的迁移,液滴温度也会发生变化。通过改变液滴溶液浓度,有可能找到一个与组织水势相同的溶液,使液滴温度不变。如果把植物组织事先冷冻,破坏细胞膜的结构,然后按上法测定,所得结果为植物组织的渗透势。而压力势为ψp=ψw-ψπ。用此法也能测定纯胶体溶液的衬质势。 (三) 压力室法 压力室(pressure chamber)法是一种快速测定枝条、完整叶水势的方法。可将植物枝条或叶片切下,导管中原为连续的水柱断裂,水柱会从切口向内部收缩。将切下的材料密封于钢制压力室中;使枝条的切割端或叶柄伸出压力室(图2-4)。测定时向压力室通压缩空气(或氮气),直至小水柱恰好重新回到切面上为止,所加的压力,称为平衡压力(balance pressure),可以从仪器的压力表上读出,加上负号即为该水柱的压力势,又由于木质部的溶质势绝对值很小,因此可用测得的压力势来近似地代表该器官的水势。该法简单迅速,被广泛应用。
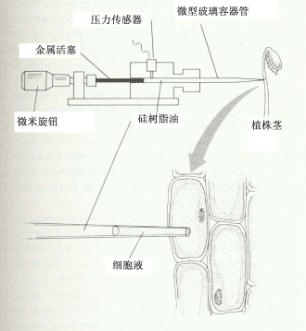
A测定装置。枝叶外用塑料袋包裹的目的是减少叶片的水分蒸发。 B示木质部中水柱的三种不同状态。(a)木质部未被切断时,水柱呈连续状; (b)木质部被切断时,因导管中的负压消失,水柱流入导管 内; (c)压力平衡时,木质部的水柱返回到切面。 (四) 测定同一细胞压力势、渗透势和水势的方法.现在已有测定单个细胞膨压的压力探针(pressure probe)和测定单个细胞渗透浓度的仪器。压力探针类似微注射器(图2-5A),其针头是一端拉尖(断面直径约1μm)的毛细管,可刺入细胞,与针头相通的注射器和置压力传感器的小室内充满了油(通常为硅油),油难以压缩,并易与细胞液区分。当针尖刺进细胞到达液泡时,由于细胞内的膨压相对较高,细胞液就会进入毛细管。转动测微计上旋钮,推动金属活塞,能使油与细胞的界面回到针头尖端,并保持平衡,这个压力(P)经压力传感器,可从仪表上读取或经记录仪记录。这样就直接测定了细胞的压力势(ψp=P)。测定细胞膨压后,利用压力探针的针头吸取该细胞的一小滴细胞液,并将此滴细胞液注入到滴加在半导体致冷器金属板上的油滴里,由于细胞液的比重比油大,沉在油里,因而细胞液中水分不被蒸发(图2-5B)。然后让半导体致冷器致冷,当油的温度下降至零下某一温度时,细胞液便凝固,此温度即为细胞液的凝固点,也为水的冰点下降值(△Tf),根据冰点下降值与溶液质量摩尔浓度(C)的关系式△Tf=1.86C(1.86为水的冰点下降常数)可求出细胞液的质量摩尔浓度(C=△Tf/1.86)即渗透浓度;将C代入渗透势计算公式,就可求出细胞液的溶质势,汁液溶质势也就是细胞的渗透势。
上述操作在解剖显微镜下进行。测微计上的旋钮可用微型电机带动。测定了细胞的ψp和ψs,根据细胞水势组成公式,就可以计算出该细胞的水势(ψw=ψp ψs)。 |
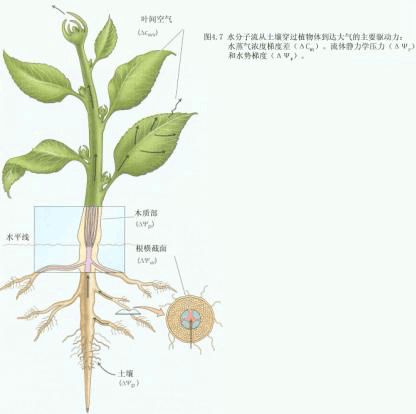
| 三、植物细胞间的水分移动 相邻两个细胞之间水分移动的方向,取决于两细胞间的水势差,水分总是顺着水势梯度移动。如甲细胞ψs为-1.5MPa,ψp为0.7MPa,其ψw为-0.8MPa;乙细胞ψs为-1.2MPa,ψp为0.6MPa,其ψw为-0.6MPa,则水分从乙细胞移向甲细胞,直到△ψw=0为止。在一排相互连接的薄壁细胞中,只要胞间存在着水势梯度,水分就会由水势高的细胞移向水势低的细胞。植物细胞、组织、器官之间,以及土壤—植物—大气连续体(soil-plant-atmosphere continum,SPAC)中,水分的转移也都符合这一基本规律。通常土壤的水势>植物根的水势>茎木质部水势>叶片的水势>大气的水势(图2-6),使根系吸收的水分可以源源不断地向地上部分输送。
|