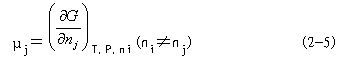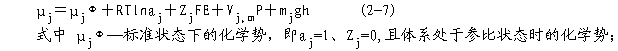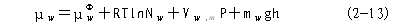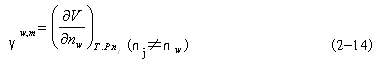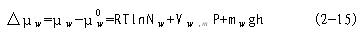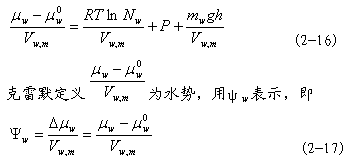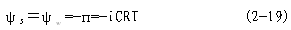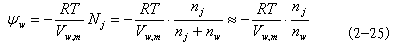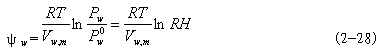水是生命起源的先决条件,没有水就没有生命。世界上最早的生命就是在逐渐冷却的海洋里由蛋白质和其他化合物产生出来的。植物也起源于水中,后来其中的一部分才逐渐进化为陆生植物。植物的一切正常生命活动都必须在细胞含有一定的水分状况下才能进行。天然植被的分布主要受供水情况所控制。农作物产量对供水的依赖性也往往超过了任何其他因素。“有收无收在于水”和“水利是农业的命脉”的道理就在这里。
植物一方面从周围环境中吸收水分,以保证生命活动的需要;另一方面又不断地向环境散失水分,以维持体内外的水分循环、气体交换以及适宜的体温。植物对水分的吸收、运输、利用和散失的过程,被称为植物的水分代谢(water metabolism)。研究植物水分代谢的基本规律,掌握合理灌溉的生理基础,满足作物生长发育对水分的需要,为作物提供良好的生态环境,这对农作物的高产、稳产、优质、高效有着重要意义。
第一节 水分与植物细胞
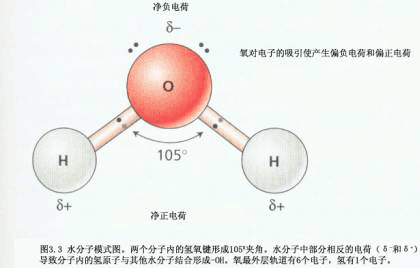
| 一、水的物理化学性质 植物对水分的吸收、运输、分布、散失以及水在植物生命活动中所起的作用都与水的结构和理化性质有关。 (一)水的组成和结构
nH2O ←→ (H2O)n 热
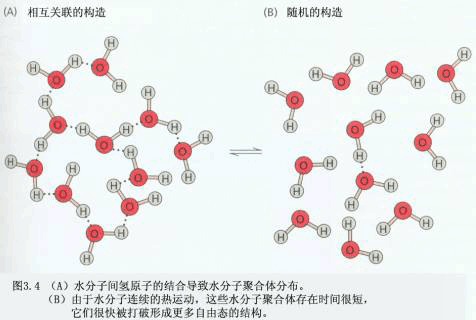
(二)水的物理化学性质 水具有许多特殊的物理化学性质。 1.水的比热容 比热容(specific heat)是指使单位质量的物质温度升高1℃所需的热量。水的比热容为4.187J·g-1·℃-1。除液态氨外,在其它的液态和固态物质中,水的比热容最大。这是因为水中存在缔合分子,当水受热时,要消耗相当多的热量来破坏氢键。当水的温度降低时,会释放出比其他液体更多的热量。由于这一特性,使水对气温、地温及植物体温有巨大的调节作用,从而有利于植物适应冷热多变的环境。 2.水的沸点和气化热 随着温度的升高,水的蒸气压增加得很快。当液体蒸气压等于外界压力时的温度称为沸点(boiling point)。要使液态的水达到沸点, 就要破坏大量的氢键,使缔合分子解离出来呈气态,这就必须提供较多的热量。在一定的温度下,将单位质量的物质由液态转变为气态所需的热量就称为气化热(vaporization heat,latent heat of vaporization)。 在正常气压(1atm)下水的沸点为100℃,此时水的气化热为2.257kJ·g-1, 在 25℃时为2.45 kJ·g-1。在所有液体中水的气化热是最大的。水的气化热高,有利于植物通过蒸腾作用有效地降低体温。 3.水的密度 水在4℃(严格讲是3.98℃)时体积最小,密度(density)最大,为1kg·dm-3。在4℃以上,温度升高,缔合分子减少,体积增大,密度减小;而在4℃以下,水的密度随着温度降低反而减小,到冰点时,全部分子缔合成一个巨大的、有较大空隙的缔合分子。由于冰的密度小,可以浮在水面上,从而使下面的水层不易结冰,有利于水生动植物的生存。 4.水的蒸气压 和其他液体一样,水分子处于不断运动之中, 其中有少数分子的动能较大,足以冲破表面张力的影响而进入空间成为水蒸气分子,这就叫蒸发(vaporization)。液面上的水蒸气分子也可重新返回液体中,这称为凝聚(condensation)。与液体达到动态平衡的蒸气称为饱和蒸气(saturation vapor)。饱和蒸气所产生的压力称为饱和蒸气压(saturation vapor pressure)。在一定温度下,每种液体的饱和蒸气压是一个常数,温度升高,饱和蒸气压增大。 5.水的内聚力、粘附力和表面张力 同类分子间具有的分子间引力叫做内聚力(cohesion)。由于水中存在大量的氢键,水的内聚力很大。液相与固相间的相互引力叫做粘附力(adhesion)。由于水是极性分子,它可以与其他极性物质形成氢键,因此水与极性物质间有较强的粘附力。如果水与某物质间的粘附力大于水的内聚力,则此物质为可湿性的。处于界面的水分子均受着垂直向内的拉力,这种作用于单位长度表面上的力,称为表面张力(surface tension)。表面张力趋于使表面积缩小,减少界面高能分子。 6.毛细作用 内聚力、粘附力和表面张力的共同作用产生毛细作用(capillarity)。毛细作用是指在液体与固体相接触的表面间的一种相互作用。植物细胞壁的纤维素微纤丝间有许多空隙,它们形成很多小而弯曲的毛细管网络。木质部中的导管就是一种管壁可湿的毛细管。但当导管充满连续水柱情况下,在导管中没有空气--水的界面,其水分移动则与毛管水移动有所不同,主要以集流方式移动。 7.水的高抗张(拉)强度 某种物质抵抗张(拉)力的能力,称之为抗张(拉) 强度(tensile strength)。水分子的内聚力很大,可达几十兆帕(MPa),因而水具有很高的抗张强度,可以抵抗水柱中的水分子彼此被拉开。 8.水的不可压缩性 自然界中液体体积难以压缩的特性称之为不可压缩性(incompressibility),水也具有该性质。 这一性质在细胞内所引起的静水压与植物气孔开闭、叶片运动、保持植株固有的姿态等方面均有密切关系。 9.水的电性质 水是一种极弱的电解质,用精密仪器测量纯水也有微弱的导电性,这说明水也能电离。由于水的电离是一个吸热过程,因此,温度升高,水的电离度增加。水具有高的介电常数(dielectric constant),这是指抵消电荷间相互吸引作用能力的一种测度。因而水是许多电解质和极性分子的良好溶剂。植物体内的蛋白质、氨基酸、碳水化合物等大分子含有-COOH、-CO、-NH2等亲水基团,水分子与这些亲水基团形成氢键,即水分子可在大分子周围定向排列,形成水化层,以减弱大分子间的相互作用,增加其溶解性,维持大分子在细胞质中的稳定性。水分子还可结合在带电荷的离子K 、Na 、Ca2 、Cl-、NO3-等的周围,使其成为高度可溶的水化离子。 |
| 二、水分在植物生命活动中的作用 水分对于植物的生命活动的作用可概括为以下几个方面: 1.水是细胞的重要组成成分 一般植物组织含水量占鲜重的75%~90%,水生植物含水量可达95%,番茄、黄瓜、西瓜约90%,树干、休眠芽约40%,风干种子约10%,藓类、地衣仅5%~7%。细胞中的水可分为二类,一类是与细胞组分紧密结合而不能自由移动、不易蒸发散失的水称为束缚水(bound water),另一类是与细胞内胶体之间吸附力较弱,可以自由移动的水称为自由水(free water)。自由水可直接参与各种代谢活动,因此,当自由水/束缚水比值高时,细胞原生质呈溶胶状态,植物的代谢旺盛,生长较快,抗逆性弱;反之,细胞原生质呈凝胶状态,代谢活性低,生长迟缓,但抗逆性强。 2.水是代谢过程的反应物质 水是光合作用的原料。在呼吸作用以及许多有机物质的合成和分解过程中都有水分子参与。没有水,这些重要的生化过程都不能进行。 3.水是各种生理生化反应和运输物质的介质 水分子具有极性,是自然界中能溶解物质最多的良好溶剂。植物体内的各种生理生化过程,如矿质元素的吸收、运输,气体交换,光合产物的合成、转化和运输以及信号物质的传导等都需以水作为介质。 4.水能使植物保持固有的姿态 植物细胞含有大量水分,可产生静水压,以维持细胞的紧张度,使枝叶挺立,花朵开放,根系得以伸展,从而有利于植物捕获光能、交换气体、传粉受精以及对水肥的吸收。 5.水具有重要的生态意义 由于水所具有的特殊的理化性质,所以水在植物的生态环境中起着特别重要的作用。例如:植物通过蒸腾散热,调节体温,以减轻烈日的伤害;水温的变化幅度小,在水稻育秧遇到寒潮时,可以灌水护秧;高温干旱时,也可通过灌水来调节植物周围的温度和湿度,改善田间小气候;此外可以水调肥,用灌水来促进肥料的释放和利用。 由上可见,植物生命活动中对水的需要,包括了生理需水与生态需水两个方面。 |
| 三、自由能、化学势、水势的基本概念 水势(water potential)是美国水分生理学家克雷默(P.J.Kramer,1966)从物理化学中引导出并运用于植物生理学的。因此,这里需引入热力学中的一些有关知识。 (一)热力学的性质和基本定律 热力学(thermodynamics)是“平衡态热力学”的简称,它是研究热和能量及其相互转变规律的科学。热力学开始是研究“热、功、能”的转化关系的,后来发展成为运用能量转化的规律来探讨物质变化的可能性、方向性和限度。从这个意义来看,热力学就是“能量学”。除了以热的形式传递之外,以其他形式传递的能量都叫做功(work)。热、功、能是可以相互转化的。 在热力学中,常把研究的某类物质及其空间称为体系(system),而将体系以外与之相联系的物质和空间称为环境(surrounding)。根据体系与环境之间有无能量与物质交换,可将体系分为三种: 一是孤立体系(isolated system):与环境不发生能量、物质交换;二是封闭体系(closed system):与环境之间只发生能量交换;三是开放体系(open system):与环境之间既有能量交换又有物质交换。植物生理过程基本属于开放体系,它们与环境之间经常发生着物质与能量的交换。 在热力学中,一个体系的状态(state)可用其性质(property)如体积、压力、温度等来描述,这些性质称为热力学变量。所谓状态函数(state function)是指由状态决定的宏观物理量,例如内能U、焓H、熵S和自由能G等,它们只与体系的特定状态有关,而与状态的演变过程(process)的具体途径(pathway)无关。 在自然界中,任何物质都处在不停地运动中,表达物质运动的量度就是能量。任何物质都具有能量,能量有各种不同的形式,并且能够从一种形式转化为另一种形式,从一个物体传递给另一个物体,而在转化和传递过程中能量的总数量保持不变,这就是能量守恒与转换定律,将其应用于热力学体系,且不考虑外部能量时,就成为热力学第一定律。体系内部的总能量叫做内能(internal energy),以U表示。体系内能发生变化,就意味着体系与环境之间发生了能量交换。由于能量交换只有两种方式,或者是通过传递热量(Q),或者是通过作功(W),所以体系内能的增量(终态与始态之间内能的差额),即△U=U2-U1,必等于体系与环境之间交换的总能量,即热量与功量的代数和(Q+W)。 △U=Q+W (2-1) 这就是热力学第一定律的数学表达式。并规定体系从环境吸热、接收功为正值; 体系放热,对外界作功为负值。内能是一种状态函数,当终态与始态固定时,其值就固定了;而热和功不是状态函数,它们与过程的具体途径有关。 在一个等压过程中只做体积功(P△V)的条件下,体系吸收的热量全部用来增加体系的另一个状态函数——焓(enthalpy,H)。此时体系的焓变(△H)和内能变化之间的关系为: △H=△U+P△V (2-2) 当反应物和产物都处于固态或液态时,P△V可忽略,故△H≈△U。凡属放热反应(如TCA 循环),△H为负值;吸热反应(如卡尔文循环)△H为正值。 自然界中许多变化过程都具有一定的方向性,即其过程自发进行之后,如果外界条件不变,则其过程就不能自发地沿着原来的途径复原,如果要使体系复原,那就必须靠外界环境做功。例如人们无论如何也不能把热从低温物体传到高温物体而不产生任何其他影响。又如在任何形式的能量转换中,必定有一部分能量以热的形式传入环境。这些就是热力学第二定律的内容。它阐明了自发过程方向或不可逆性。根据热力学第二定律,在孤立体系的任何自发过程(不可逆过程)中,体系的混乱度(disorder chaos)是趋于增加的。混乱度可以用一个热力学变量——熵(entropy,S)来表示。体系越混乱,熵值越大。熵是一个状态函数。体系在终态与始态之间的熵增量△S等于可逆过程的热温商∑δQR/T或大于不可逆过程的热温商∑δQIR/T(即体系中的熵增量只有一部分来自环境),可用下列式子表示: △S≥∑δQ/T (2-3) 式2-3就是热力学第二定律的数学表达,它只是说明了一个过程可能的方向。式中等号指可逆过程,大于号指不可逆过程。 当一个体系达到平衡状态时,过程是可逆的,体系加上环境的熵达到最大,其△S=0。一个体系越远离平衡态,其熵值越小,△S>0,发生变化的可能性越大。△S可用来判断变化的方向性和限度。 将热力学两条基本定律联系起来看,在孤立体系中,能量守恒;而其状态和过程是单方向进行的(从非平衡到平衡,即由△S>0到△S=0终止)。 把熵增量△S来作为判断某过程变化方向的依据,很抽象,使用不方便。为此,引入新的“状态函数”——Gibbs自由能(free energy),用字母G表示。它等于物质的焓减去它的绝对温度和熵的乘积(G=H-TS)。在等温、等压条件下,能够做最大非体积功(W′)如电功等的那部分能量就是自由能(-△GT.P.=W′max)。凡是满足了等温、等压条件且不做非体积功(即W′=0)的变化过程都可以用自由能增量(△G)来判断变化方向和限度。△G可以等于零,也可以小于零,即: △GT.P.≤0 (2-4) 上式中等号适用于可逆过程(平衡状态),不等号适用于不可逆过程(非平衡状态)。在等温等压过程中,可以用△G判断过程自发与否。当△G<0时,过程自发进行(即体系的自动变化总是朝着自由能减小的方向进行);△G>0,过程不可能自发进行(其逆过程是自发的)。其次,上述(2-4)式也可指出反应的能量极限,一个自发过程,向着平衡状态的方向进行,△G<0,可以做功,此过程是放能的(exergonic),其最大释放量等于△G之值。一个反自发过程,向着远离平衡状态的方向进行,△G>0,则此过程是吸能的(endergonic),外界至少供给相当于△G的自由能方可逆进行。这种吸能反应必须与另一个放能反应相耦联(couple),才有可能发生。△G=0,过程处于平衡状态。 (二)化学势 在物理化学中,用化学势来描述体系中各组分发生化学反应的本领及转移的潜在趋势。 化学势(chemical potential)以希腊字母μ表示。组分j的化学势μj定义为某组分j的偏摩尔自由能。
对于封闭体系,溶液中某组分j的化学势可用下式表示:
R--气体常数(8.314J?mol-1-?K-1); T--绝对温度; aj--物质j的相对活度,为无量纲的纯数,可以取对数; Zj--物质j所带电荷数,(阳离子为正,阴阳离子为负); F--法拉第常数(96.5KJ?mol-1?V-1); E--物质j所处体系的电势(V); Vj.m--物质j的偏摩尔体积(L?mol-1); P—体系压力与相对参比状态压力(0.1013MPa)的差值,或溶液静水压力与大气压力的差值; g--重力加速度,即质量转换成的系数(9.8m?s-2=9.8kg·m·s-2=9.8N?kg-1); h--体系相对于参比状态的高度差(m); mj--物质j的摩尔质量(kg?mol-1); 通常将包括电项ZjFE的μj称为电化学势(electrochemical potential);而将不包括电项,即物质j不带电荷或电势E为0, ZjFE=0的μj称为化学势。当物质j从体系1 转移到体系2(或环境)时,其电化学势μj之增量为: △μj=μj2-μj1 (2-8) =(μj RTlnaj2 ZjFE2 Vj,mP2 mjgh2)-(μj0 RTlnaj1 ZjFE1 Vj,mP1 mjgh1) =RTln(aj2/aj1) ZjF△E Vj,m△P mjg△h (2-9) 如果体系1与体系2的压力和高度相同(如细胞吸收离子),那么上式变为: μj=RTln(aj2/aj1) ZjF△E (2-10) 若△μj<0时,物质j就会自发地由体系1转移到体系2,并且每摩尔物质j在此转移过程中释放出的自由能至多等于△μj之值;但若△μj>0,则物质j不能自发地由体系1转移到体系2,欲使其转移,则至少要供给它自由能等于△μj之值。而向相反的方向,即物质由体系2转移到体系1,是可以自发进行的;若△μj=0,则表示在两个体系中物质j的化学势相等,处于平衡状态。由上可见,△μj=μj2-μj1表示物质j起反应或转移的潜在策动力。 总之,在任一化学反应或相变体系中,物质的转移方向和限度是以化学势高低来决定的。物质总是从化学势高的地方自发地转移到化学势低的地方,而化学势相等时,则呈现动态平衡。 (三)水的化学势与水势 水的运动方向和限度同样遵循热力学第二定律,水分也具有自身的自由能和化学势。水的化学势的热力学含义是:当温度、压力及物质数量(水分以外)一定时,由水量(摩尔增量)引起的体系自由能的改变量。水的化学势用μ 表示。
由于水不带电荷(Z=0),电项ZwFE即为0,所以水的化学势可以用下式表示: μw=μ0w+RTlnaw+Vw,mP+mwgh (2-12) 在稀溶液中水的化学势亦可写成:
m —水的摩尔质量18×10-3kg?mol-1
水的化学势可用来判断水分参加化学反应的本领或两相间移动的方向和限度。水的化学势和其他热力学量一样,不用绝对值,而用相对值△μ ,在一定条件下的纯自由水的化学势μ 被选为水的化学势的比较标准。所以,水的化学势差△μ 就是体系中水的化学势μ 与同温度下纯水的化学势μ 之差值,即:
在式(2-11)中,化学势的单位是J·mol-1(J=N·m),偏摩尔体积的单位是m3·mol-1,故水势的单位是:J·mol-1/m3·mol-1=J·m-3=N·m-2=Pa(帕)或用MPa(兆帕)。它与过去常用的压力单位巴(bar)或大气压(atm)的换算关系是: 1MPa=106Pa=10bar=9.87atm 水分的移动和其他物质一样是顺着能量梯度(energy gradient)的方向进行的。在任何两个相邻部位之间或两个相邻细胞之间,水分总是从水势高处移向水势低处,直到两处水势差为0为止。 |
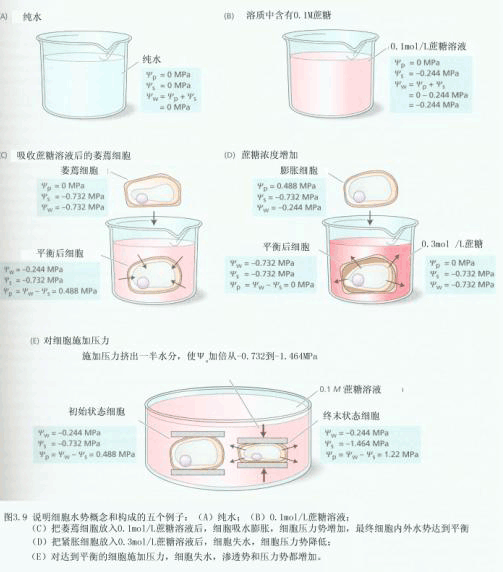
| 四、含水体系的水势组分 对于任何一个含水体系来说,其水势会受到体系内部因素和环境因素的影响而发生变化。凡是能改变水分子μw的各种因素都会引起水势的改变。使体系水势增高的因素有:①正压力;②升高温度;③升高海拔高度。使体系水势降低的因素有:①溶质;②衬质;③负压力;④毛细管力;⑤降低温度; ⑥降低海拔高度。在温度不变的情况下,若将溶质(S)、衬质(m)、压力(P)、重力(g)等诸因素可视为独立变量,则这些因素对体系水势的贡献可分别称为溶质势(ψs)、衬质势(ψm)、压力势(ψp)、重力势(ψg)等。当这些水势能单独对体系水势产生影响时,则体系的水势就等于各水势之和: ψw=ψs+ψm+ψp+ψg (2-18) 1.纯水的水势ψ 所谓纯水是指不以任何物理的或化学的方式与任何物质结合的水,完全是自由水,ψ 为零,ψ 为零;在标准压力(1.013×105Pa)下,在与体系同温度之下,重力势忽略时,纯水水势为零。从水势的定义式(2-17)可推导出,纯水的水势为零(因为在纯水体系中μ =μ0w=0,△μ =0,所以ψ =0)。 2.溶质势ψ (solute potential) 指由于溶质颗粒的存在而引起体系水势降低的数值。在标准压力下,溶液的水势等于其溶质势。溶液的溶质愈多,其溶质势愈低,且任一溶液的水势均低于纯水的水势而为负值。在渗透系统中溶质势表示了溶液中水分潜在的渗透能力的大小,因此,溶质势又可称为渗透势(osmotic potential,ψ )。稀溶液的溶质势可用范特霍夫(Vant Hoff)公式,计算渗透压(п)的(经验公式)来计算:
3.衬质势ψ (matrix potential)表面能够吸附水分的物质(如纤维素、蛋白质颗粒、淀粉粒、土粒等物质)常被称为衬质(matrix),它具有潜在的吸水本领。由于衬质的存在引起体系水势降低的数值称为衬质势。体系中的衬质是否对体系水势有影响,体系的总水势是否包含衬质势,这要视具体情况而定。一般认为,当衬质吸水达到平衡后,衬质对体系水势就没有什么影响,此时衬质具有的水势等于体系的水势,即在体系总水势中就不包含衬质具有的水势。为了与衬质势加以区别,在此把衬质本身所具有的水势叫衬质水势(matrix water potential)。干燥的衬质表面水势很低,可达-300MPa,吸附水后,衬质水势迅速增高,被水饱和时衬质水势趋于0。 4.压力势ψ (pressure potential)由于压力的存在而使体系水势改变的数值。ψ 会随压力变化而变化,加正压力,使体系水势升高。如果讨论同一大气压力下两个开放体系间水势差时,压力势可忽略不计。 5.重力势ψg(gravitational)由于重力的存在使体系水势增加的数值,称重力势。重力使水向下移动,即处于较高位置的水比较低位置的水有较高的水势。当体系中的两个区域高度相差不大时,重力势可忽略不计。 6.溶液的水势ψ 根据溶液的渗透压与N 具有以下关系式:
ψw=ψπ ψp ψg (2-22) 若两个溶液的高度相同,所受压力相同,那么在研究这两个体系水势差时,ψp和ψg可省略不计。在不考虑压力和重力影响时,稀溶液的水势可按下式计算:
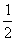 x2 x2 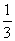 x3 ……)≈-x。据此,ln(1-Nj)≈-Nj,2-24式可改写成: x3 ……)≈-x。据此,ln(1-Nj)≈-Nj,2-24式可改写成:
将(2-26)式代入(2-25)式
而对于气相的水势公式则按下式计算:
P --为纯水的饱和蒸气压; RH--为相对湿度。 |
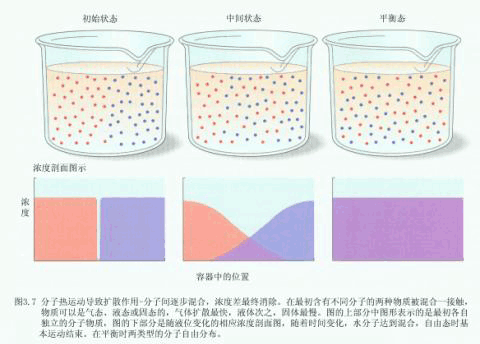
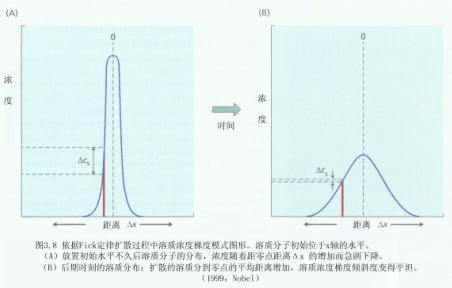
| 五、水的移动 水在自然界,包括在植物体内的移动,不外乎二种形式:集流与扩散。而渗透作用是扩散的一种特殊形式。 (一)集流 集流(mass flow或bulk flow)是指液体中成群的原子或分子(例如组成水溶液的各种物质的分子)在压力梯度(水势梯度)作用下共同移动的现象。例如水管中水的流动、河水的流动、降雨、土壤空隙中的水、动物血管中的水和植物维管束中水的流动等。 在压力梯度下水的集流是植物体中的水经木质部或韧皮部做长距离移动的主要机制。依靠水的集流能使土壤中的无机养分和叶片制造的光合产物运往植物体的各个部分。与扩散不同,集流与物质的浓度无关,即与溶质势无关。 (二)分子扩散
菲克定律(Fick′s law)指出:扩散速度与物质的浓度梯度成正比:
渗透作用(osmosis) 是指溶液中的溶剂分子通过半透膜(semipermeable membrane)扩散的现象。对于水溶液而言,就是指水分子从水势高处通过半透膜向水势低处扩散的现象。
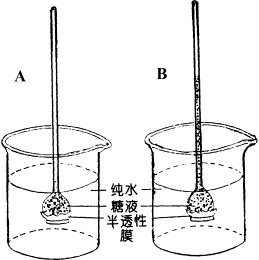
半透膜也叫选择透性膜,是只容许混合物(溶液、混合气体)中的一些物质透过,而不容许另一些物质透过的薄膜。如透析袋、动物膀胱、花生皮、蚕豆壳等都有半透膜的性质。渗透作用可用图2-1的装置来演示。在一长颈漏斗中加入一定浓度的蔗糖溶液,并在漏斗口紧缚一半透膜,将其倒置于盛有纯水的烧杯中,使烧杯中的纯水与漏斗内的蔗糖溶液保持在同一水平面。由于漏斗口装有半透膜,所以水分子可以自由透过,而蔗糖分子不能通过,再加上纯水的水势高于蔗糖溶液的水势,所以纯水中的水分子会自发地向漏斗内运转而使漏斗内的液面逐渐升高。这样,由于渗透作用会使漏斗内水分子增多,膜上的静水压逐渐增加,而静水压又会使糖液中的水分子通过半透膜向烧杯内运转。当静水压增大到漏斗内半透膜上方蔗糖液中的水势与烧杯内纯水的水势相等时,水分子通过半透膜的进出即达到动态平衡。这时半透膜上方的压力势就等于负的糖液的渗透势。
a.烧杯中的纯水和漏斗内液面相平; b.由于渗透作用使烧杯内水面降低而漏斗内液面升高
|