三羧酸循环等呼吸代谢过程中脱下的氢被NAD 或FAD所接受。细胞内的辅酶或辅基数量是有限的,它们必须将氢交给其它受体之后,才能再次接受氢。在需氧生物中,氧气便是这些氢的最终受体。这种有机物在生物活细胞中所进行的一系列传递氢和电子的氧化还原过程,称为生物氧化(biological oxidation)。生物氧化与非生物氧化的化学本质是相同的,都是脱氢、失去电子或与氧直接化合,并产生能量。然而生物氧化与非生物氧化不同,它是在生活细胞内,在常温、常压、接近中性的pH和有水的环境下,在一系列的酶以及中间传递体的共同作用下逐步地完成的,而且能量是逐步释放的。生物氧化过程中释放的能量可被偶联的磷酸化反应所利用,贮存在高能磷酸化合物(如ATP、GTP等)中,以满足需能生理过程的需要。
 |
线粒体中氧化磷酸化反应的一般机理
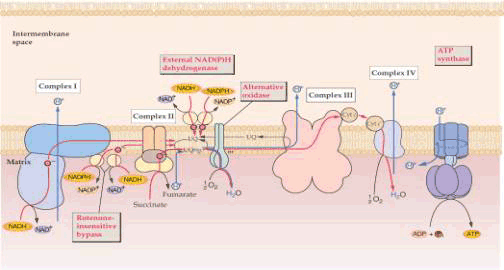
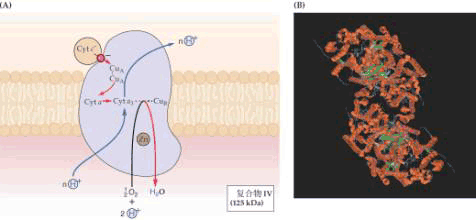
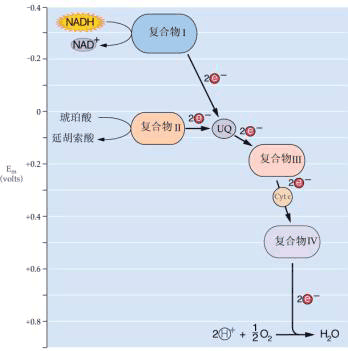
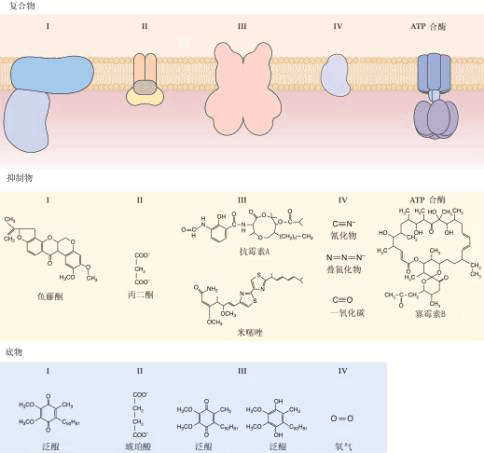
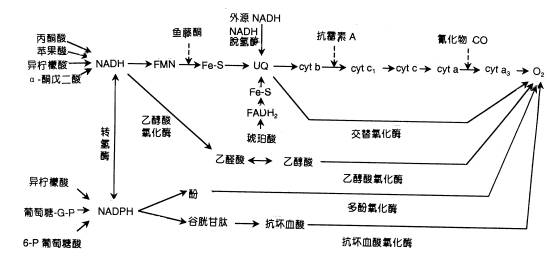
| 一、呼吸链的概念和组成 所谓呼吸链(respiratory chain)即呼吸电子传递链(electron transport chain),是线粒体内膜上由呼吸传递体组成的电子传递总轨道。呼吸链传递体能把代谢物脱下的电子有序地传递给氧,呼吸传递体有两大类:氢传递体与电子传递体。氢传递体包括一些脱氢酶的辅助因子,主要有NAD 、FMN、FAD、UQ等。它们既传递电子,也传递质子;电子传递体包括细胞色素系统和某些黄素蛋白、铁硫蛋白。呼吸链传递体传递电子的顺序是:代谢物→NAD →FAD→UQ→细胞色素系统→O2。 呼吸链中五种酶复合体(enzyme complex)的组成结构和功能简要介绍如下(图5-11,5-12)。
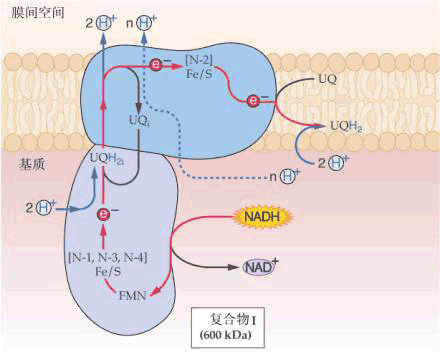
Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ分别代表复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ; UQ库代表存在于线粒体中的泛醌库 1.复合体Ⅰ 又称NADH∶泛醌氧化还原酶(NADH∶ubiquinone oxidoreductase)。 分子量700X103~900X103,含有25种不同的蛋白质,包括以黄素单核苷酸(flav in mononucleotide,FMN)为辅基的黄素蛋白和多种铁硫蛋白,如水溶性的铁硫蛋白(iron sulfur protein,IP)、铁硫黄素蛋白(ironsulfur flavoprotein,FP)、泛醌(ubiquinone,UQ)、磷脂(phospholipid)。复合体Ⅰ的功能在于催化位于线粒体基质中由TCA循环产生的NADH+H 中的2个H 经FMN转运到膜间空间,同时再经过Fe-S将2个电子传递到UQ(又称辅酶Q,CoQ);UQ再与基质中的H 结合,生成还原型泛醌(ubiquinol,UQH2)。该酶的作用可为鱼藤酮(rotenone)、杀粉蝶菌素A(piericidin A)、巴比妥酸(barbital acid)所抑制。它们都作用于同一区域,都能抑制Fe-S簇的氧化和泛醌的还原。
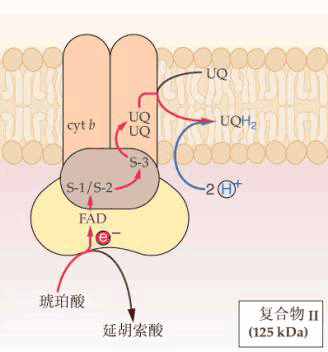
2.复合体Ⅱ又称琥珀酸 泛醌氧化还原酶(succinate∶ubiquinone oxidoreductase)分子量约140×103,含有4~5种不同的蛋白质,主要成分是琥珀酸脱氢酶(succinate dehydro genase,SDH)、黄素腺嘌呤二核苷酸(flavin adenine dinucleotide, FAD)、细胞色素b(cytochrome b)和3个Fe-S蛋白。复合体Ⅱ的功能是催化琥珀酸氧化为延胡索酸,并将H转移到FAD生成FADH2,然后再把H转移到UQ生成UQH2。该酶活性可被2-噻吩甲酰三氟丙酮(thenoyltrifluoroacetone,TTFA)所抑制。
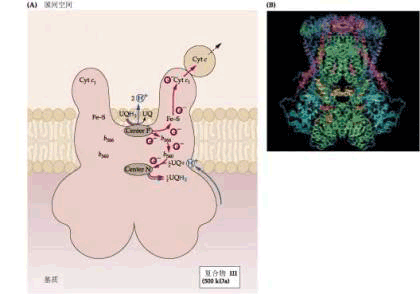
3.复合体Ⅲ 又称UQH2∶细胞色素C氧化还原酶(ubiquinone∶cytochrome c oxidoreductase),分子量250×103,含有9~10种不同蛋白质,一般都含有2个Cyt b,1个Fe-S蛋白和1个Cyt c1。复合体Ⅲ的功能是催化电子从UQH2经Cyt b→FeS→Cytc1传递到Cyt c,这一反应与跨膜质子转移相偶联,即将2个H 释放到膜间空间。也有人认为在电子从Fe-S传到Cyt c1之前,先传递给UQ,同时UQ与基质中的H 结合生成UQH2。UQH2再将电子传给Cytc1,同时将2个H 释放到膜间空间。
4.复合体Ⅳ 又称Cyt c∶细胞色素氧化酶(Cyt c∶cytochrome oxidase)分子量约160~170×103,含有多种不同的蛋白质,主要成分是Cyta和Cyta3及2个铜原子,组成两个氧化还原中心即Cyta CuA和Cyta3 CuB,第一个中心是接受来自Cyt c 的电子受体,第二个中心是氧还原的位置。它们通过Cu Cu2 的变化,在Cyta和Cyta3间传递电子。其功能是将 Cyt c中的电子传递给分子氧,氧分子被Cyta3、CuB还原至过氧化物水平;然后接受第三个电子,O-O键断裂,其中一个氧原子还原成H2O;在另一步中接受第四个电子,第二个氧原子进一步还原。也可能在这一电子传递过程中将线粒体基质中的 2个H 转运到膜间空间。CO、氰化物(cyanide,CN-)、叠氮化物(azide,N3-)同O2竞争与Cytaa3中Fe的结合,可抑制从Cytaa3到O2的电子传递。
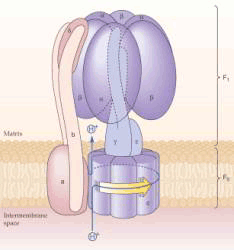
5.复合体Ⅴ 又称ATP合成酶(adenosine triphosphate synthase)或H -ATP酶复合物。由8种不同亚基组成,分子量分别是8.2×103~55.2×103,它们又分别组成两个蛋白质复合体(F1-F0)。F1从内膜伸入基质中,突出于膜表面,具有亲水性,酶的催化部位就位于其中。F0疏水,嵌入内膜磷脂之中,内有质子通道(图5-12),它利用呼吸链上复合体Ⅰ、Ⅲ、Ⅳ运行产生的质子能,将ADP和Pi合成ATP,也能催化与质子从内膜基质侧向内膜外侧转移相联的ATP水解。
示传递质子的F2单位和合成ATP的单位 在电子传递链0组分中UQ和Cyt c是可移动的。其中UQ是一类脂溶性的苯醌衍生物,含量高,广泛存在生物界,故名泛醌,是电子传递链中非蛋白质成员,能在膜脂质内自由移动,通过醌/酚结构互变,在传递质子、电子中起“摆渡”作用。它是复合体Ⅰ、Ⅱ与Ⅲ之间的电子载体。Cyt c是线粒体内膜外侧的外周蛋白,是电子传递链中唯一的可移动的色素蛋白,通过辅基中铁离子价的可逆变化,在复合体Ⅲ与Ⅳ之间传递电子。 |
| 二、氧化磷酸化 (一)磷酸化的概念及类型 生物氧化过程中释放的自由能,促使ADP形成ATP的方式一般有两种,即底物水平的磷酸化和氧化磷酸化。 1.底物水平磷酸化(substrate level phosphorylation)指底物脱氢(或脱水),其分子内部所含的能量重新分布,即可生成某些高能中间代谢物,再通过酶促磷酸基团转移反应直接偶联ATP的生成。在高等植物中以这种形式形成的ATP只占一小部分,糖酵解过程中有两个步骤发生底物水平磷酸化: (1) 甘油醛-3-磷酸被氧化脱氢,生成一个高能硫酯键,再转化为高能磷酸键,其磷酸基团再转移到ADP上,形成ATP。 (2) 2-磷酸甘油酸通过烯醇酶的作用,脱水生成高能中间化合物(PEP),经激酶催化转移磷酸基团到ADP上,生成ATP。 在TCA循环中,α-酮戊二酸经氧化脱羧形成高能硫酯键,然后再转化形成高能磷酸键生成ATP。 2. 氧化磷酸化(oxidative phosphorylation) 是指电子从NADH或FADH2经电子传递链传递给分子氧生成水,并偶联ADP和Pi生成ATP的过程。它是需氧生物合成ATP的主要途径。电子沿呼吸链由低电位流向高电位是个逐步释放能量的过程。有些学者认为,电子在两个电子传递体之间传递转移时释放的能量如可满足ADP磷酸化形成ATP的需要时, 即视为氧化磷酸化的偶联部位(coupled site)或氧化磷酸化位点。2mol电子在从NADH传递到O2这一氧化过程中,其自由能变化△G°′为-220kJ·mol-1。已知在pH为7和存在Mg2 的条件下,由ADP磷酸化形成ATP至少需要 35.1kJ·mol-1的能量,电子从NADH到UQ之间△G°′为-51.90kJ·mol-1(部位I),从Cyt b到Cyt c之间△G°′为-38.5kJ·mol-1(部位Ⅱ),从Cytaa3到O2之间△G°′为-103.81kJ·mol-1部位Ⅲ),这样在三个部位释放的能量都大于35.1kJ·mol-1,即都足以分别合成 1molATP。 氧化磷酸化作用的活力指标为P/O比,是指每消耗一个氧原子有几个ADP变成ATP。呼吸链从NADH开始至氧化成水,可形成3分子的ATP,即P/O比是3。NADH+H +3ADP+3Pi+1O2NAD +3ATP+H2O(5-15)如从琥珀酸脱氢生成的FADH2通过泛醌进入呼吸链,则只形成2分子的ATP,即P/O比是2。 FADH2+2ADP+2Pi+O2→FAD+2ATP+H2O (5-16)
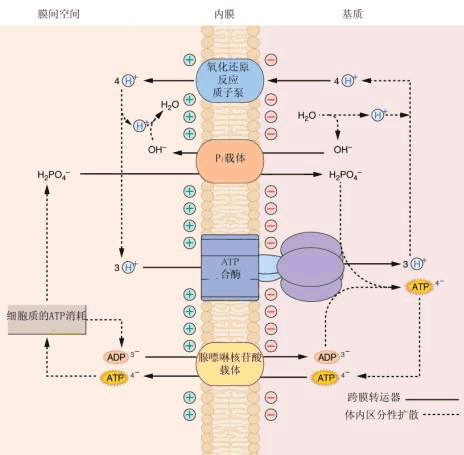
(二)氧化磷酸化的机理 在电子传递过程中所释放出的自由能是怎样转入ATP分子中的, 这就是氧化磷酸化作用的机理问题。有多种假说,如化学偶联学说、化学渗透学说和构象学说。不过,目前为大家所公认的、实验证据较充足的是英国生物化学家米切尔的化学渗透学说。根据该学说的原理,呼吸链的电子传递所产生的跨膜质子动力是推动ATP合成的原动力(图5-13)。其要点如下:
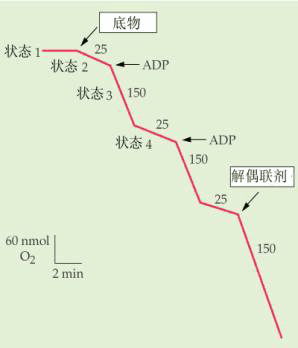
1.呼吸传递体不对称地分布在线粒体内膜上 呼吸链上的递氢体与电子传递体在线粒体内膜上有着特定的不对称分布,彼此相间排列,定向传递。 2.呼吸链的复合体中的递氢体有质子泵的作用 它可以将H 从线粒体内膜的内侧泵至外侧。一般来说一对电子从NADH传递到O2时,共泵出6个H 。从FADH2开始,则共泵出4个H 。膜外侧的H ,不能自由通过内膜而返回内侧,这样在电子传递过程中,在内膜两侧建立起质子浓度梯度(△pH)和膜电势差(△E),二者构成跨膜的H 电化学势梯度△μH ,若将△μH 转变为以电势V为单位,则为质子动力[见(4-32)式]。 质子的浓度梯度越大,则质子动力就越大,用于合成ATP的能力越强。 3.由质子动力推动ATP的合成 质子动力使H 流沿着ATP酶(偶联因子)的H 通道进入线粒体基质时,释放的自由能推动ADP和Pi合成ATP(图5-14)。 化学渗透学说已得到充足的实验证据。当把线粒体悬浮在无O2缓冲液中,通入O2时,介质很快酸化,跨膜的H 浓度差可以达到1.5pH单位,电势差达0.5V,内膜的外表面对内表面是正的,并保持相对稳定,证实内膜不允许外侧的H 渗漏回内膜内侧。但当加入解偶联剂2,4-二硝基苯酚(DNP)时,跨膜的H 浓度差和电势差就不能形成,就会阻止ATP的产生。有人将嗜盐菌的紫膜蛋白和线粒体ATPase嵌入脂质体,悬浮在含ADP和Pi溶液中,在光照下紫膜蛋白从介质中摄取H ,产生跨膜的H 浓度差,推动ATP的合成。当人工建立起跨内膜的合适的H 浓度差时,也发现ADP和Pi合成了ATP。
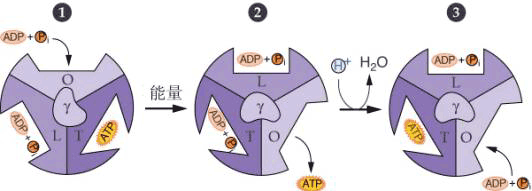
F1复合物有三个核苷酸结合位点。每一部位有三种完全不同的结构状态。松散的核苷酸结合部位(L),紧密核苷酸结合部位(T)和开放核苷酸结合部位(O)。在任何时候。F1复合物包括这三种不同的结构,其中有一个与酶复合物的每一个催化中心相连。ADP和Pi开始被结合到开放状态未被占有的部位(1)。质子运动通过F0释放能量引起γ亚单位旋转。这种旋转自发改变了三个核苷酸结合位点的构造。结合有ATP的T型被转变成O型,ATP被释放出来。同时,结合有ADP和Pi的L型被转化成T型,疏水性的结合正有利于ATP生成。第上步中结合ADP和Pi的开放部位转化或松散型结构(2)。被紧密结合的ADP和Pi转化生成ATP,此步骤不需消耗能量和构型改变(3) (三)氧化磷酸化的解偶联剂和抑制剂
1.解偶联剂(uncoupler) 植物在遇到干旱或某些化学物质作用时,会抑制ADP形成ATP的磷酸化作用,但不抑制电子传递,使电子传递产生的自由能以热的形式散失掉,导致氧化过程与磷酸化作用不偶联,这就是氧化磷酸化解偶联现象。能对呼吸链产生氧化磷酸化解偶联作用的化学试剂叫解偶联剂。最常见的解偶联剂有DNP,含有一个酸性基团的DNP是脂溶性的,可以穿透线粒体内膜,并把一个H 从膜外带入膜内,从而破坏了跨内膜的质子梯度,抑制了ATP的生成。解偶联时会促进电子传递的进行,O2的消耗加大。 2.抑制剂(depressant) 抑制剂与解偶联剂的区别在于,这类试剂不仅抑制ATP的形成,还同时抑制O2的消耗。这是因为像寡霉素(oligomycin)这一类的化学物质可以阻止膜间空间中的H 通过ATP合成酶的F0进入线粒体基质,这样不仅会阻止ATP生成,还会维持和加强质子动力势,对电子传递产生反馈抑制,O2的消耗就会相应减少。 3.离子载体抑制剂(ionophore depressant) 离子载体抑制剂与解偶联剂的区别在于它不是H 载体,而是可能和某些阳离子结合,生成脂溶性的复合物,并作为离子载体使这些离子能够穿过内膜,这样就增大了内膜对某些阳离子的通透性;同时因为在转运阳离子到基质中时消耗了自由能,降低了质子动力,从而抑制了ATP的形成。例如缬氨霉素(valinomycin)与K+形成的复合物较易通过内膜进入基质,会抑制氧化磷酸化过程。 |
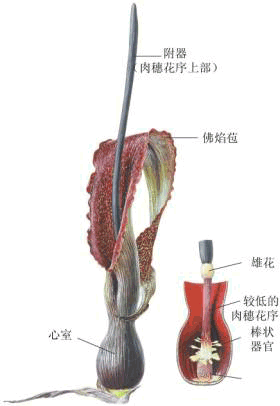
| 三、抗氰呼吸 (一)抗氰呼吸的电子传递途径及其特性 在某些植物中,CN-对末端氧化过程不起抑制作用。汤佩松在1932年报导了CO不能完全抑制羽扇豆细胞对氧气的吸收。这种在氰化物存在条件下仍运行的呼吸作用,称为抗氰呼吸(cyanide resistant respiration),也即是对氰化物不敏感的那一部分呼吸。抗氰呼吸可以在某些条件下与电子传递主路交替运行,抑制正常电子传递途径就可促进抗氰呼吸的发生,因此,抗氰呼吸这一呼吸支路又称为交替途径(alternative pathway)。 NADH→FMN→FeS→UQ..Cyt bFeS、Cytc1...Cytc..Cytaa3→O2 (5-17) 电子自NADH脱下后,经FMN—FeS传递到UQ,然后不是进入细胞色素电子传递系统,而是从UQ处分岔,经FP和交替氧化酶(alternative oxidase,AO)把电子交给分子氧,该途径可被鱼藤酮抑制,不被抗霉素A和氰化物抑制,其P/O比为1或低于1。1973年,有人用一种非典型的抗氰植物小麦为材料,通过改变其生理条件(如不同氧分压)而导致高度抗氰支路的形成。用乙烯处理甘薯切片,细胞线粒体内膜磷脂减少,抗氰呼吸显著增强。这表明呼吸电子传递途径是可以改变的。 在高等植物中抗氰呼吸是广泛存在的,例如天南星科、睡莲科和白星海芋科的花器官与花粉,玉米、水稻、豌豆、绿豆和棉花的种子、马铃薯的块茎、甘薯的块根和胡萝卜的根等。此外在黑粉菌、酵母菌等多种微生物中也发现有抗氰呼吸的存在。抗氰呼吸虽然普遍,但并非存在于所有植物中,而且抗氰的程度也有很大差别。最著名的抗氰呼吸例子是天南星科植物的佛焰花序,它的呼吸速率很高,可达每g鲜重15 000~20 000μl·g-1·h-1,比一般植物呼吸速率快100倍以上,同时由于呼吸放热,可使组织温度比环境温度高出10~20℃。因此,抗氰呼吸又称为放热呼吸(thermogenic respiration)。
(二)抗氰呼吸的生理意义 抗氰呼吸的生理意义尚不十分清楚。据推测,有以下几方面: 1.放热增温,促进植物开花、种子萌发 抗氰呼吸释放大量热量,有助于某些植物花粉的成熟及授粉、受精过程;有利于挥发引诱剂(如NH3、胺类、吲哚等),以吸引昆虫帮助传粉。放热增温也有利于种子萌发。种子在萌发早期或吸胀过程中都有抗氰呼吸的存在。例如棉花种子吸胀开始时抗氰呼吸占35%,6h后达到70%。 2.增加乙烯生成,促进果实成熟 促进衰老在正常条件下,抗氰呼吸的出现常与衰老相联系。随着植株年龄的增长、果实的成熟,抗氰呼吸随之升高。同时,乙烯与抗氰呼吸上升有平行的关系。乙烯刺激抗氰呼吸,诱发呼吸跃变产生,促进果实成熟和植物组织器官衰老。1961年,梁厚果发现白兰瓜果实成熟期的“跃变呼吸”是由抗氰氧化酶控制的,即主要依赖于抗氰呼吸的提高。 3.在防御真菌的感染中起作用 甘薯块根组织受到黑斑病菌侵染后抗氰呼吸成倍增长,而且抗病品种感染组织总是明显高于感病品种感染组织,由此可知,抗氰呼吸的强弱与甘薯块根组织对黑斑病菌的抗性有着密切关系。 4.分流电子 当细胞含糖量高(如光合作用旺盛),EMP-TCA循环迅速进行时,交替氧化酶活性很高。一些人认为,当细胞色素主路电子饱和发生满溢(overflow)时,交替途径起到了分流电子的作用。 |
| 四、呼吸链电子传递多条途径 20世纪70年代以来对线粒体中呼吸链电子传递途径的深入研究。证明在高等植物中的呼吸链电子传递具有多种途径。至少有下列五条(图5-15): 1.电子传递主路 即细胞色素系统途径,在生物界分布最广泛,为动物、植物及微生物所共有。这条途径的特点是电子传递通过了泛醌及细胞色素系统到达O2,对鱼藤酮、抗霉素A 、氰化物都敏感,该途径的P/O比≤3。 2.电子传递支路之一 这条途径的特点是脱氢酶的辅基不是FMN及Fe-S,而是另一种黄素蛋白(FP2),电子从NADH上脱下后经FP2直接传递到UQ,不被鱼藤酮抑制,但对抗霉素A、氰化物敏感,其 P/O比为2或略低于2。 3.电子传递支路之二 这条途径的特点是脱氢酶的辅基是另外一种黄素蛋白(FP3),其P/O比为2。其他与支路之一相同。
4.电子传递支路之三 这条途径的特点是脱氢酶的辅基是另外一种黄素蛋白(FP4), 电子自NADH脱下后经FP4和Cyt b5直接传递给Cyt c, 对鱼藤酮、抗霉素A敏感,可被氰化物所抑制,其P/O比为1。 5.交替途径 即抗氰呼吸,电子从NADH经FMN、Fe-S、UQ、FP,由交替氧化酶传至氧,P/O比为1。现将植物呼吸链多条电子传递途径作以下比较。
|
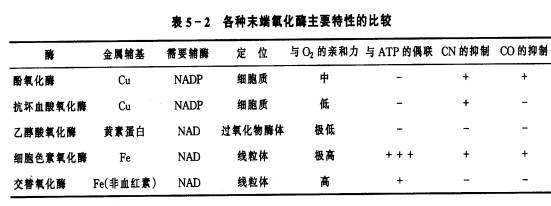
| 五、末端氧化系统的多样性 参与生物氧化反应的有多种氧化酶,其中处于呼吸链一系列氧化还原反应最末端,能活化分子态氧的酶被称为末端氧化酶(terminal oxidase)。 研究得比较清楚的,除了线粒体膜上的细胞色素氧化酶和抗氰氧化酶之外,还有存在于细胞质中的可溶性氧化酶(soluble oxidase),如酚氧化酶(phenol oxidase)、抗坏血酸氧化酶(ascorbate oxidase)和乙醇酸氧化酶(glycolate oxidase)等。它们的特性列于表5-2。
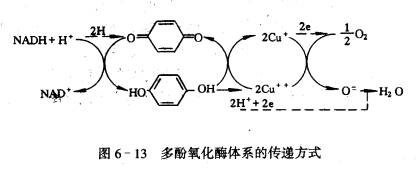
交替氧化酶又名抗氰氧化酶(cyanideresistant oxidase),其作用是将UQH2的电子经FP传给O2生成H2O。交替氧化酶的分子量为27×103~37×103,Fe2 是其活性中心的金属。该酶对O2的亲和力高,易被水杨基氧肟酸(salicylhydroxamic acid, SHAM)所抑制。 酚氧化酶可分为单元酚氧化酶(monophenol oxidase)如酪氨酸酶(tyrosinase)和多元酚氧化酶(polyphenol oxidase)如儿茶酚氧化酶(catechol oxidase)。酚氧化酶存在于质体、微体中,它可催化分子氧对多种酚的氧化,酚氧化后变成醌,并进一步聚合成棕褐色物质。这些酶与植物的“愈伤反应”有密切关系。植物组织受伤后呼吸作用增强,这部分呼吸作用称为“伤呼吸”(wound respiration)。伤呼吸把伤口处释放的酚类氧化为醌类,而醌类往往对微生物是有毒的,这样就可避免感染。当苹果或马铃薯被切伤后,伤口迅速变褐,就是酚氧化酶的作用。在没有受到伤害的组织细胞中,酚类大部分都在液泡中,与氧化酶类不在一处,所以酚类不被氧化。在制茶和烤烟加工中都要根据酚氧化酶的特性加以利用。
线粒体外的氧化酶在呼吸作用中不是主要的氧化酶,仅起一些辅助作用。这是因为它们与氧化磷酸化不相偶联,它们与氧的亲和力都较低(表5-2)。在正常情况下,植物呼吸被CN-、CO等所抑制,这表明呼吸作用电子传递的末端氧化酶主要是细胞色素氧化酶。然而,由于植物体内含有多种呼吸氧化酶,这就使植物能适应各种外界条件。以对氧浓度的要求而论,细胞色素氧化酶对氧的亲和力极高,所以在低氧浓度的情况下,仍能发挥良好的作用,而酚氧化酶对氧的亲和力弱,只能在较高氧浓度下才能顺利发挥作用。在苹果果肉中,细胞色素氧化酶主要分布在内层,而酚氧化酶主要分布在表层,这正好反映了酶对氧供应的适应 |
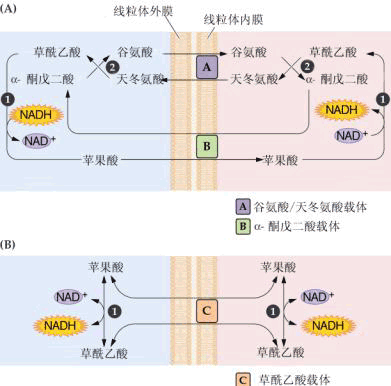
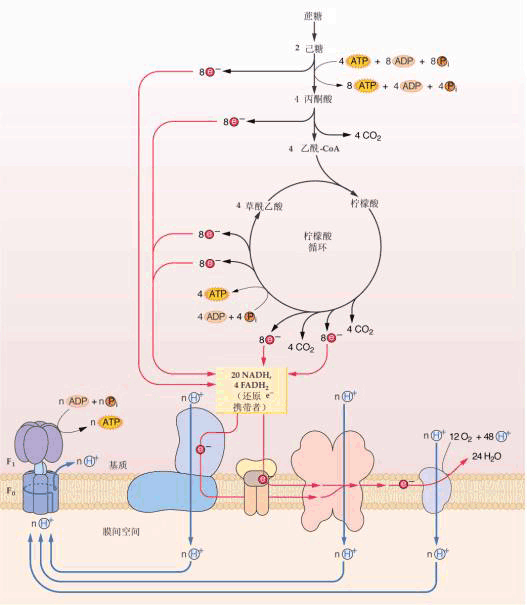
| 六、呼吸作用中的能量代谢 呼吸作用通过一系列的酶促反应把贮存在有机物中的化学能释放出来,一部分转变为热能而散失掉,一部分以ATP形式贮存,以后当ATP分解成ADP和Pi时,就把贮存在高能磷酸键中的能量再释放出来,供植物生长发育利用。 图 5-16 甘油-3-磷酸穿梭机制 呼吸作用中lmol的葡萄糖通过EMP-TCA循环和电子传递链被彻底氧化为CO2和H2O,其中在EMP途径中通过底物水平磷酸化,可产生4molATP,但在葡萄糖磷酸化时要消耗掉2molATP,所以净生成2molATP。同时在真核细胞中,底物脱氢反应生成的2molNADH,必须从细胞质进入线粒体,才能通过电子传递链氧化磷酸化生成ATP,然而NADH不能直接渗入线粒体,而需要通过甘油-3-磷酸(glycerol3phosphate,GP)—二羟丙酮磷酸(dihyd roxyacetone phosphate,DHAP)穿梭往返线粒体(图5-16)。胞质中的甘油-3-磷酸脱氢酶(glycerol3phosphate dehydrogenase)先将NADH中的氢转给DHAP形成GP,然后透过线粒体外膜进入膜间空间,被内膜上结合的甘油-3-磷酸脱氢酶氧化为DHAP,又扩散回到细胞质,循环使用;与上述反应偶联生成的FADH2进入呼吸链,经过氧化磷酸化只能生成2mol ATP。这样在GP往返过程中消耗掉1mol ATP。因此,EMP中生成的2mol NADH经氧化磷酸化后,只能生成4mol ATP,加上底物水平磷酸化净生成2mol ATP共计生成6mol ATP。1mol葡萄糖在TCA循环中可生成8mol NADH和2mol FADH2,它们进入呼吸链经氧化磷酸化,1mol NADH和FADH2可分别生成3mol和2mol ATP,再加上由琥珀酰CoA转变为琥珀酸时形成的2molATP,因此在真核细胞中1mol葡萄糖经EMP-TCA循环-呼吸链彻底氧化后共生成36mol ATP,其中32molATP是氧化磷酸化作用产生的,4molATP是底物水平的磷酸化作用产生的。
真核细胞中葡萄糖在pH7条件下经EMP-TCA循环-呼吸链被彻底氧化,其中放能部分: C6H12O6 6O2 →6CO2 6H2O △G°′=-2870kJ·mol-1 (5-18) 吸能部分: 36ADP 36Pi→36ATP △G°′=31.8×36=1144.8kJ·mol-1 (5-19) 所以其能量转换效率为1144.8/2870即39.8%,其余的60.2%以热的形式散失,其能量转换效率还是比较高的。对原核生物来说,EMP中形成的2mol NADH可直接经氧化磷酸化产生6mol ATP,因此1mol葡萄糖彻底氧化共生成38mol ATP,其能量转换效率为1208.4/2870,即42.1%,比真核细胞的要高一些。 |
| 七、光合作用和呼吸作用的关系 绿色植物通过光合作用把CO2和H2O转变成富含能量的有机物质并释放氧气;同时也通过呼吸作用把有机物质氧化分解为CO2和H2O同时放出能量供生命活动利用。光合作用和呼吸作用既相互对立,又相互依赖,它们共同存在于统一的有机体中。光合作用与呼吸作用在原料、产物、发生部位、发生条件以及物质、能量转换等方面有明显的区别,见表5-3。
—光合作用……呼吸作用(李合生,1998) |